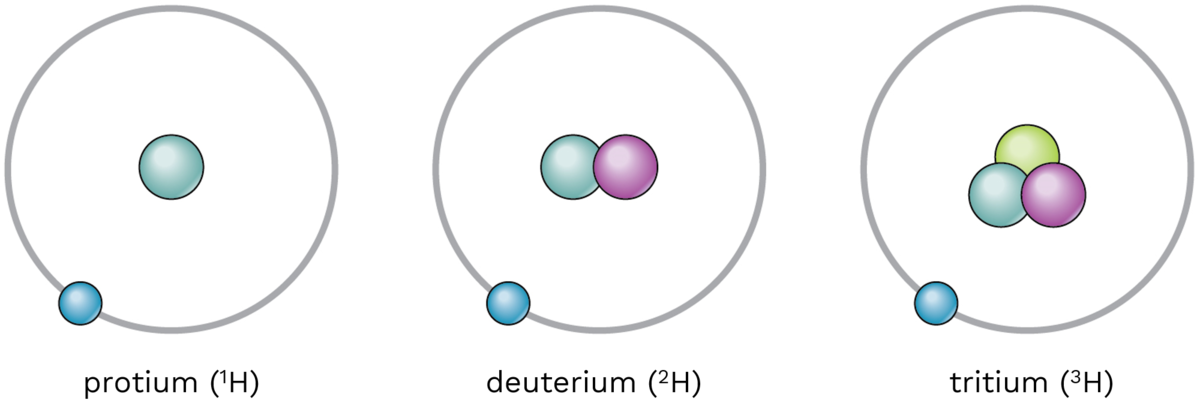
Hydrogen er det lettaste og minste av grunnstoffa. Hydrogenatomet er det enklaste av alle atom. Det inneheld berre eitt elektron og eitt proton.
Faktaboks
- Norsk namn
- hydrogen
- Også kjend som
-
vasstoff (bokmål: vannstoff) fram til rundt 1960
- Uttale
- hydrogˈen
- Engelsk namn
- hydrogen
- Relativ atommasse
- 1,00794
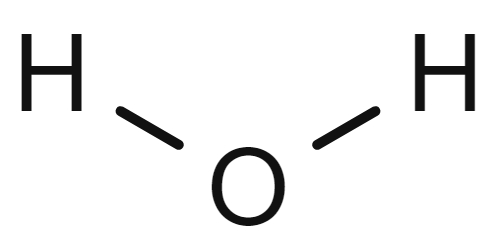
Hydrogen er det vanlegaste grunnstoffet som finst. 90 prosent av alle atom i universet er hydrogenatom. På Jorda er det meste av hydrogenet bunde i vatnmolekyl, som har kjemisk formel H2O og består av to hydrogenatom og eit oksygenatom.
Ordet hydrogen blir òg brukt som kortform for hydrogengass, noko som kan gi opphav til misforståingar. Hydrogengass består av to hydrogenatom kobla saman (H2). Hydrogengass er ein brennbar gass ved romtemperatur.










Kommentarar
Kommentarar til artikkelen blir synleg for alle. Ikkje skriv inn sensitive opplysningar, for eksempel helseopplysningar. Fagansvarleg eller redaktør svarar når dei kan. Det kan ta tid før du får svar.
Du må være logga inn for å kommentere.