Elektrolyse er en kjemisk reaksjon som går ved hjelp av elektrisk strøm. Reaksjonen foregår vanligvis i en væske eller smelte, men kan også foregå i et fast stoff.
elektrolyse
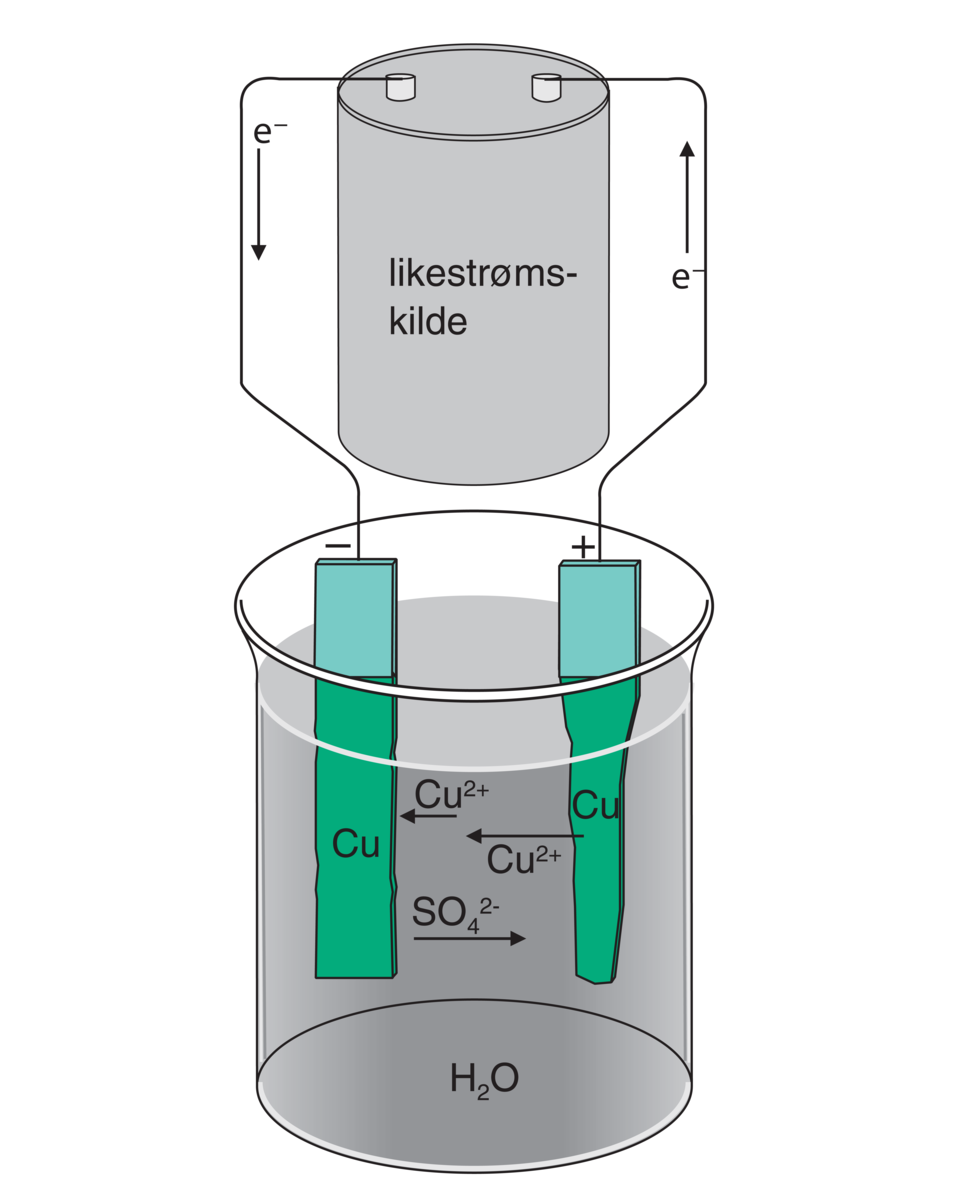
Elektrolyse. Rensing av kobber ved elektrolyse. Katodereaksjon: Cu2+ + 2e− → Cu(s). Anodereaksjon: Cu(s) → Cu2+ + 2e−.
Virkningsmekanisme
Den kjemiske reaksjonen som foregår ved elektrolyse kalles en redoksreaksjon. Under elektrolysen reduseres de positive ionene (kationene) ved at de tar opp elektroner fra den negative elektroden (katoden). Samtidig oksideres de negative ionene (anionene) ved at de avgir elektroner ved den positive elektroden (anoden).
Antallet elektroner som avgis av katoden er lik antallet elektroner som anoden opptar. Det er energien fra den ytre strømkilden som driver redoksreaksjonen ved elektrodene.
Eksempel: Fremstilling av klorgass
Ved elektrolyse av en vannløsning av vanlig bordsalt (natriumklorid) reduseres vann til hydrogengass ved katoden, og løsningen blir basisk:
\[\ce{2H2O +2e^{−} -> H2 + 2OH^{−}}\]
Ved anoden oksideres kloridioner til klorgass:
\[\ce{2Cl^{-} -> Cl2 +2e−}\]
Nettoreaksjonen får vi ved å legge sammen ligningene og stryke elektronene på hver side:
\[\ce{2H2O + 2Cl^{-} -> H2 + 2OH^{-} + Cl2}\]
Elektrolyse av vann tilsatt en elektrolytt (et salt) med ioner som ikke deltar i redoksreaksjonene på elektrodene, gir hydrogengass og oksygengass. Den motsatte reaksjonen, som er spontan, kan benyttes i en brenselcelle.
Omsetning
Mengdene av de stoffene som omsettes ved hver elektrode kan beregnes ved hjelp av kjemisk støkiometri.
Tidligere ble mengdene beregnet ved hjelp av Faradays lover:
- Når en elektrisk strøm går gjennom en elektrolytt, er den utskilte stoffmengden proporsjonal med ladningen som har gått gjennom elektrolytten, det vil si med produktet av strømmen og den tiden strømmen har gått.
- Samme ladning vil utskille ekvivalente stoffmengder (masse dividert med kjemisk ekvivalentvekt) av forskjellige stoffer.
Den spenningen som må legges over elektrodene for at elektrolyse skal skje i en gitt elektrolyttløsning, kan beregnes fra spenningsrekken og er opptil et par volt.
For å få mer praktiske spenninger ved industrianlegg, kobles flere elektrolyseceller i serie. Den totale elektriske energien som brukes, er proporsjonal med både spenningen og ladningen. I praksis er energiutbyttet mindre enn det teoretiske på grunn av overspenning og sidereaksjoner.
Bruk
Elektrolyse av vannløsninger kalles våtelektrolyse. Eksempler på noen tekniske prosesser er fremstilling av klorgass, natronlut, kaliumklorat, hydrogengass og oksygengass, og utvinning og raffinering av kobber, sink, kadmium og nikkel. Plettering av metaller (sølvplett, fornikling og lignende) er også elektrolyseprosesser
Metaller som ville reagere med vann, for eksempel natrium, magnesium, aluminium og titan, kan ikke fremstilles ved våtelektrolyse, fordi det da ville utvikles hydrogengass i stedet for at det avsettes metall på elektroden. Da gjøres i stedet elektrolysen i en vannfri saltsmelte. Metoden kalles smelteelektrolyse.
Les mer i Store norske leksikon




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.