Oksygen er et grunnstoff som ved romtemperatur er en fargeløs og luktfri gass. I vanlig luft er det omtrent 21 prosent oksygen.
Faktaboks
- Også kjent som
-
tidligere kalt surstoff
- Uttale
- oksygˈen
- Engelsk navn
- oxygen
- Relativ atommasse
- 15,9994
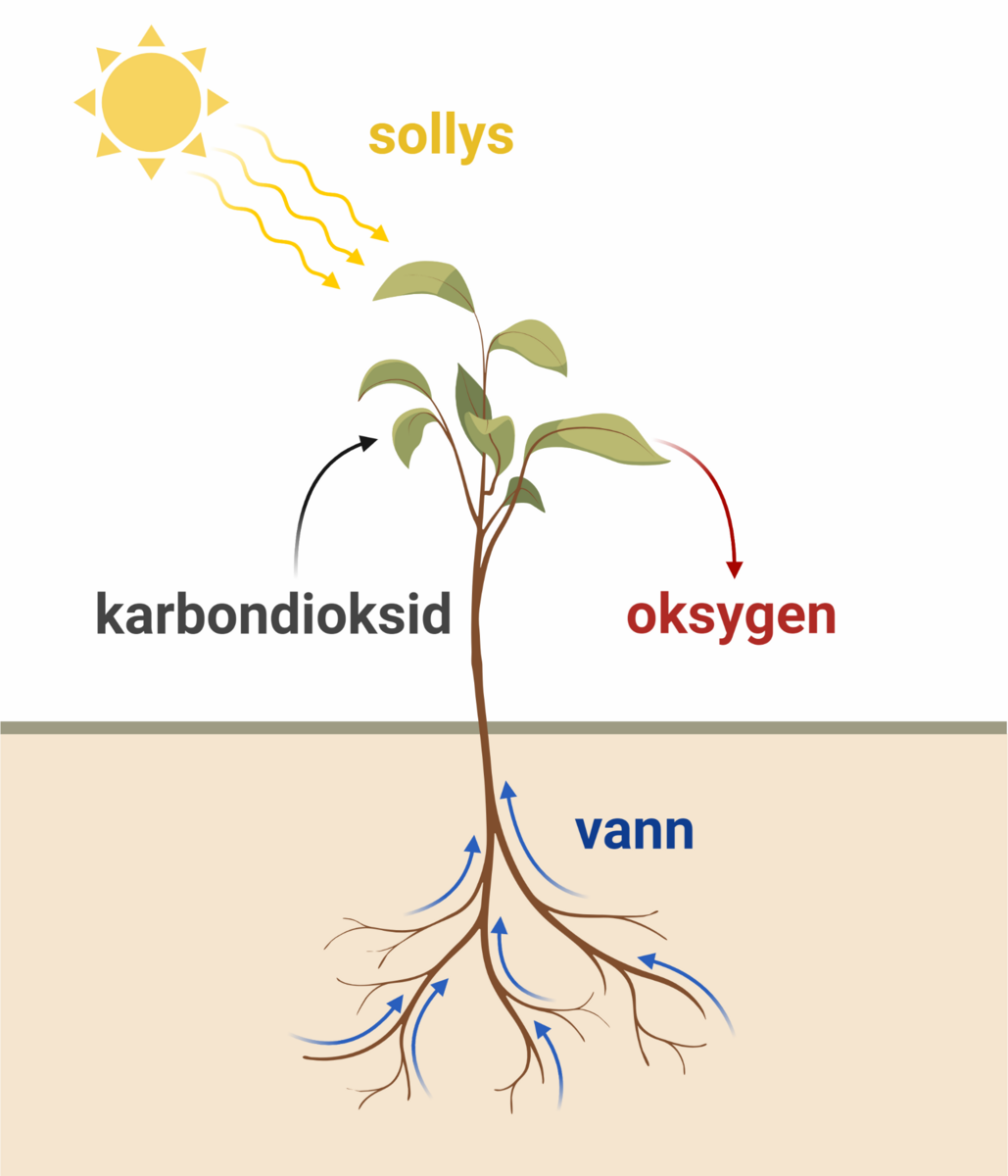
Oksygen er sentralt for alt liv på Jorden. Gjennom fotosyntesen bruker grønne planter karbondioksid og slipper ut oksygengass. Mennesker og dyr bruker oksygen i celleåndingen, det vil si når næringsstoffer brytes ned og frigjør energi.
- Se også oksygen – fysiologi og oksygenkretsløpet.







Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.