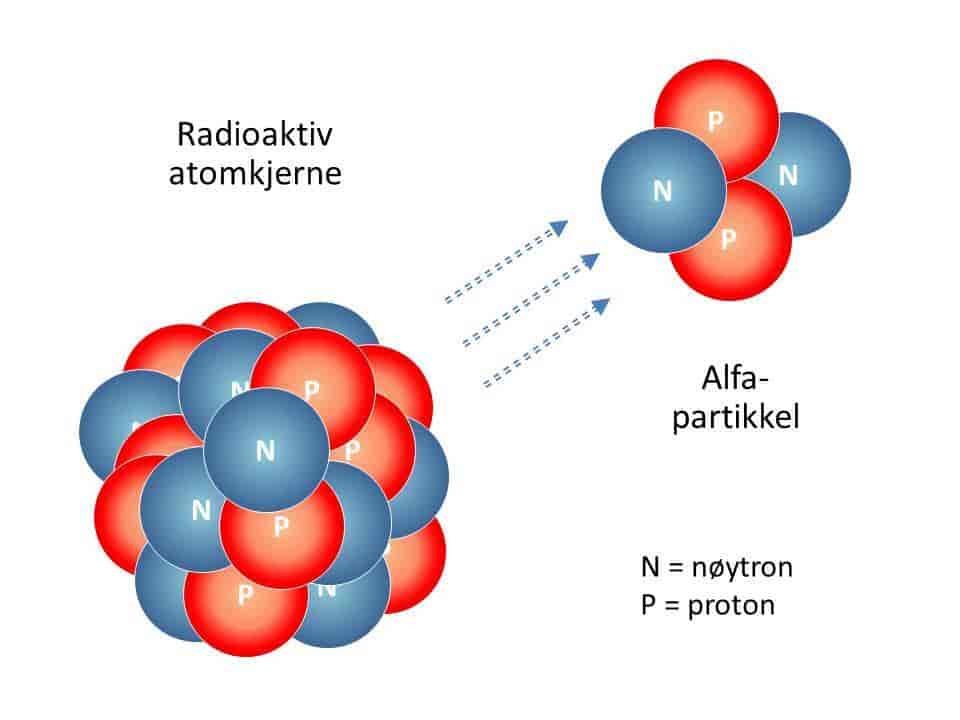
Heliumgass består av molekyler som består av bare ett atom. Atomkjernen består av to protoner og to nøytroner, og det er to elektroner som går rundt kjernen.
Helium er en edelgass og er det første grunnstoffet i gruppe 18 i periodesystemet. Det er det minst reaktive av alle grunnstoffer, og den nest letteste av alle gasser – bare hydrogengass er lettere. Helium er uten farge, lukt og smak.
Helium har det laveste kokepunkt av alle stoffer, −268,9 grader celsius (°C), det vil si 4,2 kelvin. Det lave kokepunktet skyldes at helium har de svakeste bindingene som finnes mellom atomer eller molekyler. Det samme forklarer hvorfor helium er minst løselig av alle gasser i vann, og hvorfor det generelt har en svært liten løselighet i alle løsemidler.
Helium finnes også i flytende form, se flytende helium.
Helium er det eneste stoffet som avgir varme når det smelter, og det omdannes til et fast stoff med romsentrert kubisk struktur (se kulepakning) først under høyt trykk.
Helium har den høyeste varmeledningsevnen av alle gasser unntatt hydrogen. At helium også har lavest løselighet i fett gjør det til den minst helsefarlige gassen å puste inn i ved høyt trykk. Derfor brukes den til å fortynne oksygengass ved dypdykking.







Kommentarer (3)
skrev Sam Sam
svarte Svein Askheim
skrev Svein Askheim
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.