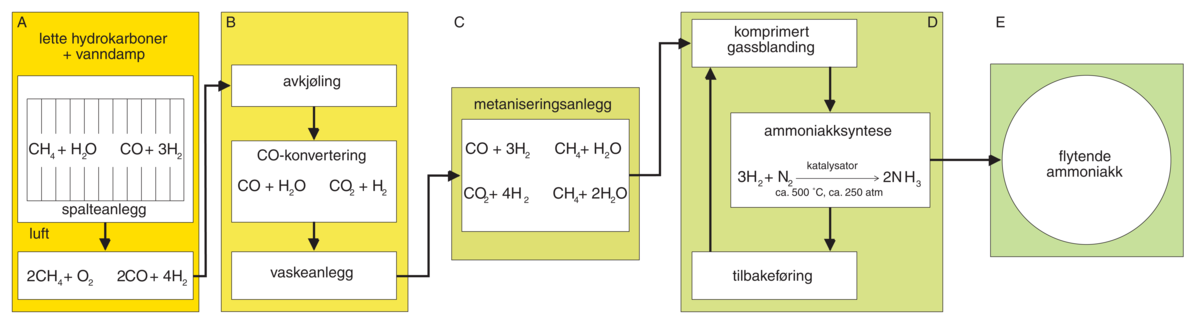
Ammoniakk produseres i vesentlig grad (75 prosent av verdensproduksjonen) etter Haber-Bosch-metoden, der nitrogen i luften reagerer med hydrogen etter følgende reaksjonsligning:
N2 (g) + 3H2 (g) → 2NH3 (g)
Her er ΔH = −92,2 kJ.
Denne fremstillingsmetoden ble opprinnelig utviklet av Fritz Haber. Fordi reaksjonen skjer under volumkontraksjon og varmeutvikling, blir utbyttet bedre jo høyere trykk og jo lavere temperatur den foregår ved. Vanlig reaksjonstemperatur er ca. 350–600 °C og trykk ca. 150–300 atm.
I dag brukes en jernbasert katalysator for å oppnå tilstrekkelig reaksjonsfart ved denne temperaturen. Etter å ha passert katalysatoren, avkjøles gassblandingen, som da inneholder ca. 17 prosent ammoniakk, slik at denne går over til væske. Det nitrogenet og hydrogenet som ikke har reagert, føres tilbake i prosessen.
Hydrogengassen som brukes i prosessen, fremstilles i dag fra naturgass. Tidligere anlegg basert på kull eller elektrolyse av vann er blitt uøkonomiske.
Noe ammoniakk produseres også etter Casale- eller Claude-metoden. Disse er i prinsippet relativt like Haber-Bosch-metoden, men går ved mye høyere trykk, henholdsvis ca. 850 atm og ca. 1000 atm, og ved en temperatur på rundt 500 °C.
-
Casale-metoden er oppkalt etter Dr. Luigi Casale (1882–1927). Den første ammoniakkproduksjonen med Casale-metoden ble startet i 1923 av Asahi i Japan, mens det sveitsiske produksjonsfirmaet Ammonia-Casale (grunnlagt i Lugano i 1921) startet ammoniakkproduksjon etter metoden i 1925. Prosessen er senere blitt modifisert flere ganger.
-
Claude-metoden er oppkalt etter den franske oppfinneren og kjemikeren Georges Claude (1870–1960) som fant opp metoden omkring 1917.
Før ble Frank-Caros metode (kalk-kvelstoff-metoden) etter Adolf Frank og Nicodemus Caro brukt, der kalsiumcyanamid, CaCN₂, spaltes av overhetet vanndamp under dannelse av ammoniakk.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.