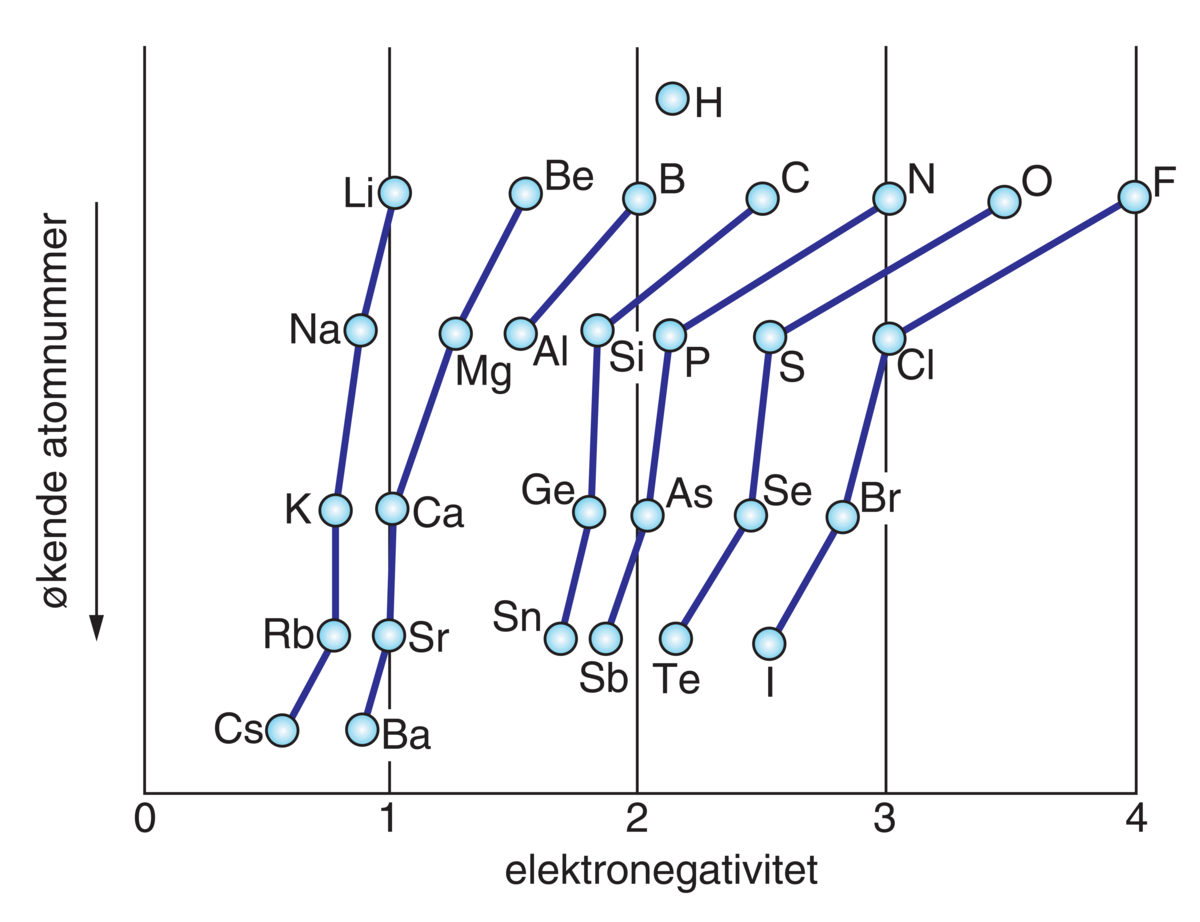
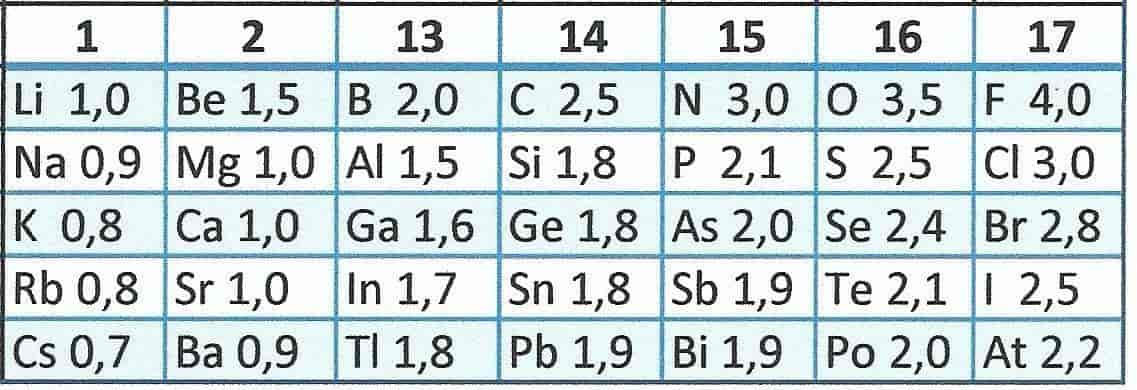
Elektronegativitet er et mål for evnen et atom har til å trekke til seg et elektronpar som det har felles med et annet atom i en kjemisk binding. Elektronparet som binder to atomer sammen, vil trekkes mot det mest elektronegative atomet.
Elektronegativitetsbegrepet er et av kjemiens mest nyttige hjelpemidler til å rasjonalisere reaksjoner og bindingsforhold. Begrepet ble innført av Linus Carl Pauling, som gav det mest elektronegative grunnstoffet, fluor, verdien 4,0. Verdien for andre grunnstoffer ble beregnet relativt til dette fra termodynamiske data.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.