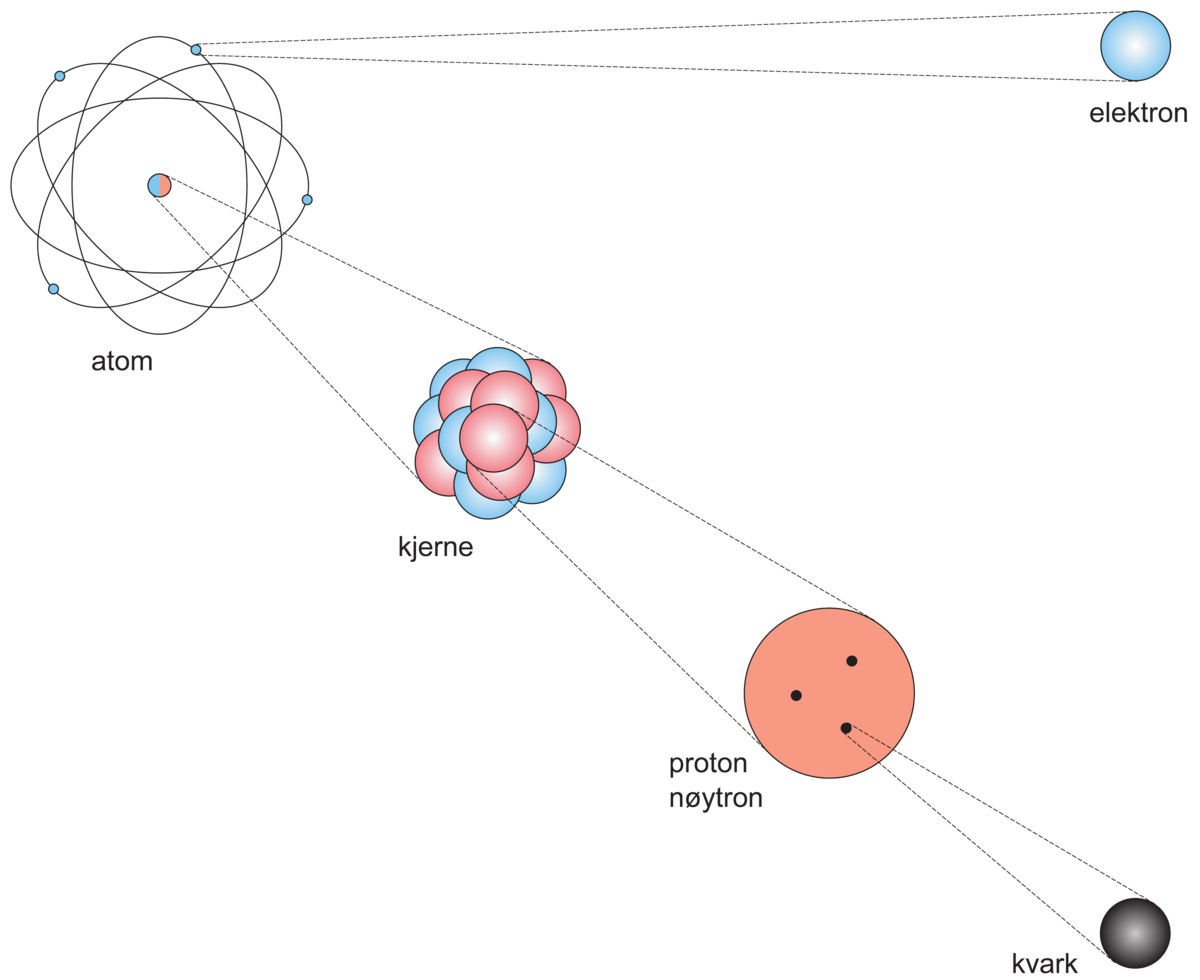
Opprinnelig forestilte man seg elektronet som en skarpt avgrenset kule med en jevn ladningsfordeling, og man kunne av verdiene for e og m bestemme radien for en slik kule, den klassiske elektronradius = 2,8·10−15 meter, eller omtrent 1/10 000 av atomets radius. Denne forestillingen om elektronet, sammen med Ernest Rutherfords oppdagelse av atomkjernen, dannet grunnlag for Niels Bohrs atommodell fra 1913, se bilde.
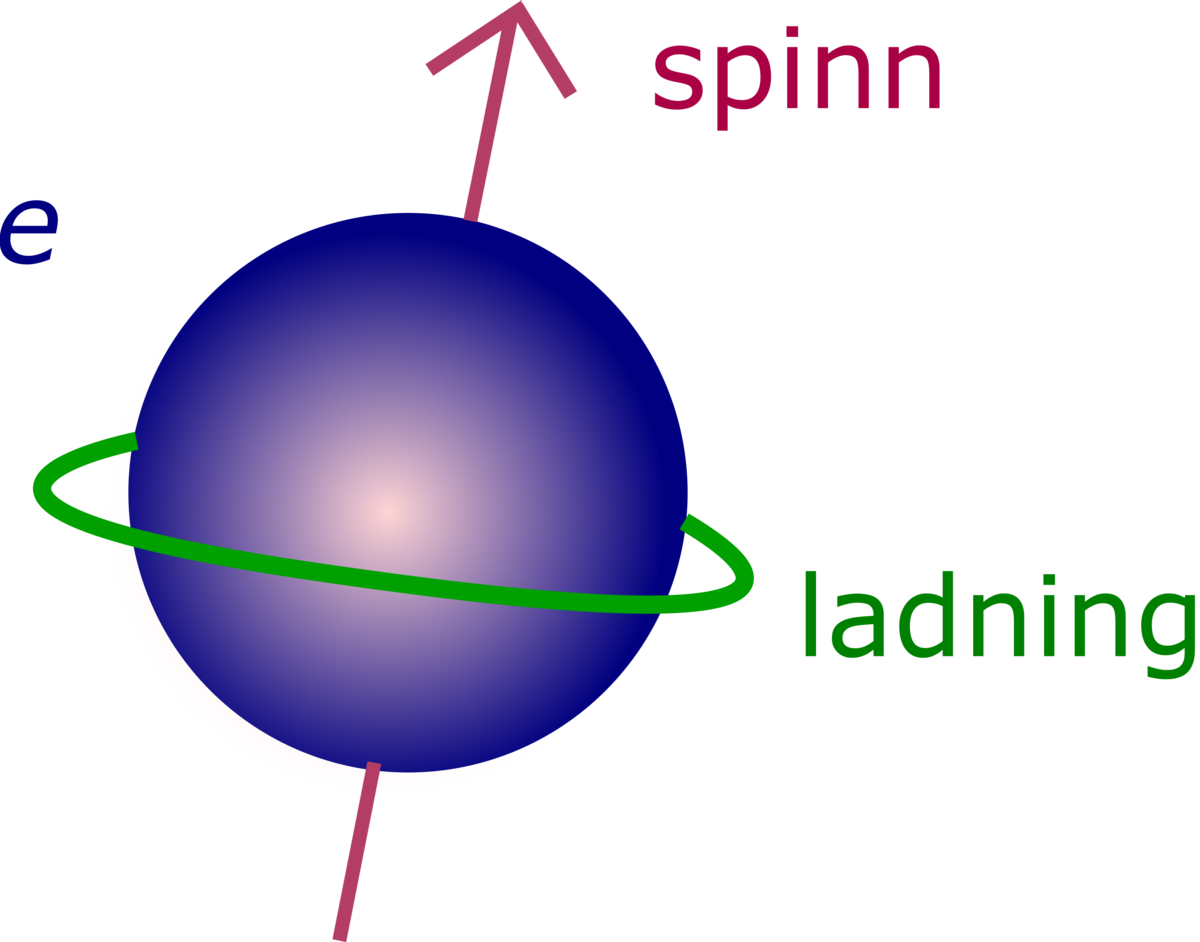
I 1925 forklarte George Uhlenbeck og Samuel Abraham Goudsmit visse forhold i atomspektrenes finstruktur ved å anta at elektronet hadde et spinn eller en egenrotasjon, og som følge av dette også et magnetisk moment. Spinnets verdi langs en bestemt retning var ½ℏ (ℏ, Plancks konstant dividert med 2π), men det magnetiske momentet viste seg å være dobbelt så stort som denne verdien tilsa ut fra klassiske betraktninger. Etter at Louis Victor de Broglie i 1924 hadde fremsatt sin teori om materiebølger, viste Clinton Joseph Davisson og Lester Halbert Germer i 1927 at elektronet hadde bølgenatur.
Året etter fremsatte Paul Adrien Maurice Dirac en helt ny teori, den relativistiske bølgeligningen, for beskrivelsen av elektronet. Det klassiske bildet, en ladd kule, ble forlatt. Isteden beskrives elektronet ved en bølgefunksjon som angir sannsynligheten for å finne det på et bestemt sted med et bestemt spinn. I motsetning til de teoriene man tidligere hadde for elektronbevegelsen i et atom, gir Diracs teori en brukbar beskrivelse også når elektronet beveger seg med store (relativistiske) hastigheter. Teorien gir også en tilfredsstillende beskrivelse av egenskaper som spinn og magnetisk moment, mens ladning og masse blir betraktet som eksperimentelt fastlagte størrelser. Diracs likning har løsninger med både positiv og negativ energi. Løsningene for negativ energi var problematiske, men man fant at disse løsningene kunne omtolkes på en slik måte at de var relatert til elektronets antipartikkel, positronet.
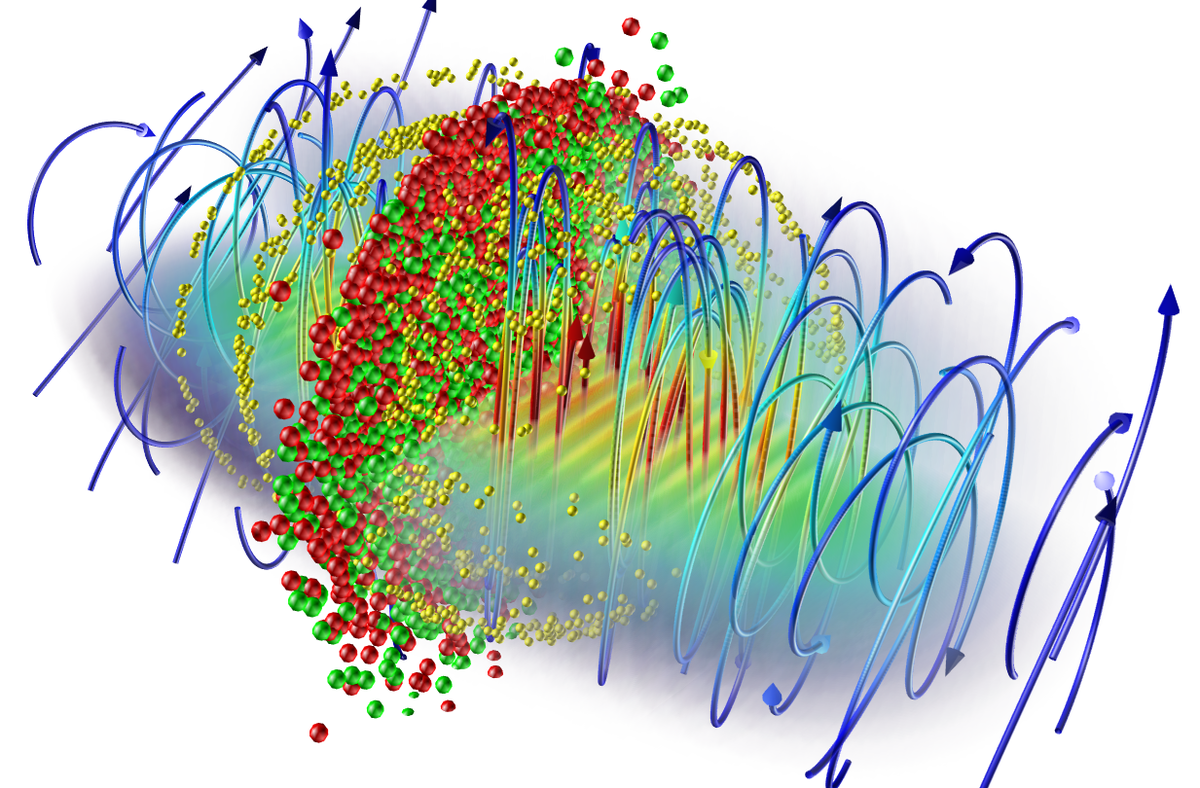
Carl David Anderson påviste i 1932 eksperimentelt eksistensen av slike positive elektroner, positroner, noe som sterkt støttet Diracs teori. Også de kjente formene for dannelse og tilintetgjørelse av elektron–positron-par, pardannelse og annihilasjon, er i overensstemmelse med Diracs teori. I elementærpartikkelfysikken brukes nå Diracs ligning til å beskrive alle fundamentale fermioner. Bildet viser et eksempel på hvordan elektroner og positroner kan skapes.
Som oftest brukes elektron som betegnelse på de negative partiklene, men til dels også som fellesbetegnelse på disse og positronene. Også betegnelsene negaton og positon har vært brukt. Elektronet hører hjemme i en gruppe av elementærpartikler som kalles leptoner (se også elementærpartikkel).





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.