Elektronskall er et klassifiseringssystem som beskriver energien som elektronene i et atom har. Hvert elektronskall har plass til et bestemt antall elektroner og karakteriseres ved et såkalt kvantetall, som sier noe om hvor stor energi elektronet har.
elektronskall
Fysisk beskrivelse
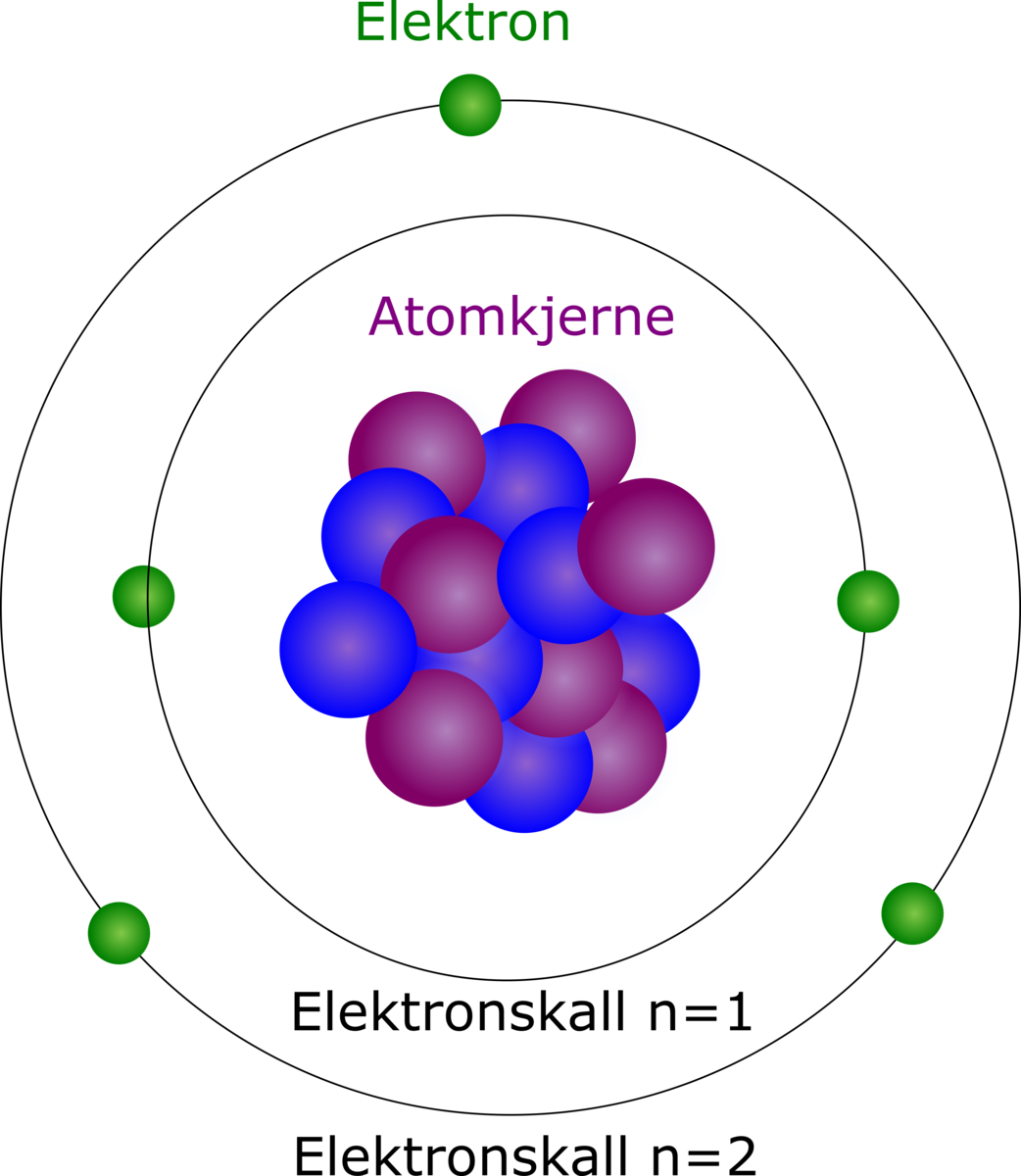
I et atom befinner elektronene (grønne kuler) seg i elektronskall (svarte sirkler). For enkelhets skyld vises kun noen av elektronene som er en del av atomet i figuren, nemlig de som befinner seg i de laveste energinivåene. Bildet er kun ment som en illustrasjon av elektronskallene: i realiteten går ikke elektronene i bestemte baner rundt atomkjernen, men er likevel karakterisert ved at de tilhører et bestemt energinivå.
I den kvantemekaniske beskrivelsen av elektroner i et atom kan elektronene kun ha bestemte energier. Disse energinivåene kalles elektronskall.
Betegnelsen elektronskall skriver seg fra Niels Bohrs opprinnelige atommodell, hvor man forestilte seg elektronene som partikler som beveget seg i atomet som planeter i et solsystem, og hvor man mente at de la seg i lag eller skall utenpå hverandre.
Etter moderne kvantefysisk oppfatning tillegger man ikke elektronene slike faste baner, men betegnelsen elektronskall brukes fremdeles for å beskrive deres energitilstand.
Et elektronskall består av en gruppe av elektroner med samme hovedkvantetall, n, eller elektrongrupper som i første tilnærmelse er i samme energitilstand i et atom.
Terminologi
Det finnes flere konvensjoner for hvordan elektronskallene betegnes.
Regnet fra laveste energitilstand benevnes skallene, av historiske grunner, ofte for K-, L-, M-, N-skall og så videre. Disse skallene kan videre deles inn i undergrupper som betegnes med bokstavene s, p, d, f og g. Disse bokstavene brukes av historiske grunner, da resultatene fra tidlige spektroskopiske målinger ble karakterisert som for eksempel sharp (s) og diffusive (d).
Et alternativ er at man karakteriserer elektronskallene ved kvantetallet n, som er et heltall. Det innebærer at skallene betegnes som n=1, n=2 og så videre.
Antall elektroner i hvert skall
I hvert elektronskall kan det bare finnes et visst antall elektroner. Et skall med kvantetall n har plass til 2n2 elektroner.
Dermed har for eksempel K-skallet (n=1) plass til to elektroner, mens L-skallet (n=2) har plass til åtte elektroner.
Les mer i Store norske leksikon




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.