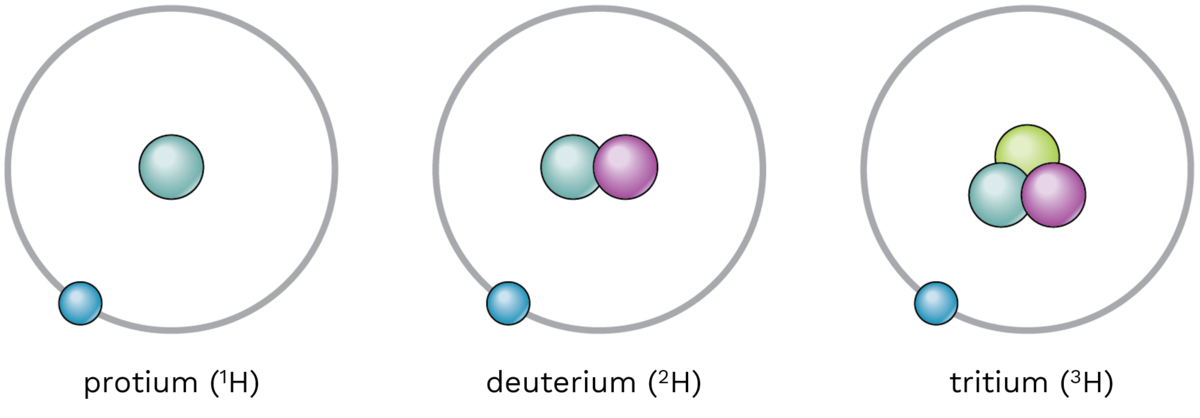
Deuterium er navnet på en isotop av hydrogen som har et nøytron i atomkjernen i tillegg til et proton. Formelen for deuterium er 2H eller D. Massen til et deuteriumatom er nær det dobbelte av et proton.
deuterium
Egenskaper
Deuterium har mange lignende egenskaper som vanlig hydrogen, men små forskjeller gjør at de kan skilles. Atommassen er 2,014102, mens vanlig hydrogen har 1,00797. Smeltepunktet for D2 er −254,4 °C, og kokepunktet er −249,5 °C. De tilsvarende verdiene for vanlig hydrogen er −259,2 °C og −252,8 °C.
Historie
Deuterium ble oppdaget av den amerikanske kjemikeren Harold Clayton Urey og medarbeidere i 1932. De begynte med hydrogen som de hadde kjølt ned til det var flytende, også destillerte de det, slik at de fikk hydrogen med en større andel deuterium. Ved hjelp av spektroskopi så de at noen linjer i spekteret hadde blitt sterkere etter destilleringen, noe som gjorde at de kunne slå fast at hydrogen hadde en tyngre isotop. For dette arbeidet fikk Urey Nobelprisen i kjemi i 1934, noe som er overraskende kort tid etter en oppdagelse.
Fremstilling
Det er to hovedmetoder for å framstille deuterium. Enten kan tungtvann produseres først, og så kan dette splittes ved elektrolyse, eller en blanding av vanlig hydrogen og deuterium kan skilles fra hverandre ved for eksempel destillasjon.
Bruk
Da hydrogen i forskjellige hydrogenforbindelser lar seg bytte ut med deuterium, har deuterium vært brukt som indikator i undersøkelser over forløpet av kjemiske reaksjoner, særlig i dyre- og planteorganismer, samt studier av strukturell oppbygging av proteiner. Deuterium har også betydelig interesse i forbindelse med energiproduserende atomkjernereaksjoner. Her fusjonerer man enten to deuteriumkjerner sammen, eller en deuteriumkjerne med en tritiumkjerne. Dette kan gjøres kontrollert i en fusjonsreaktor, eller ukontrollert i en hydrogenbombe.
Les mer i Store norske leksikon





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.