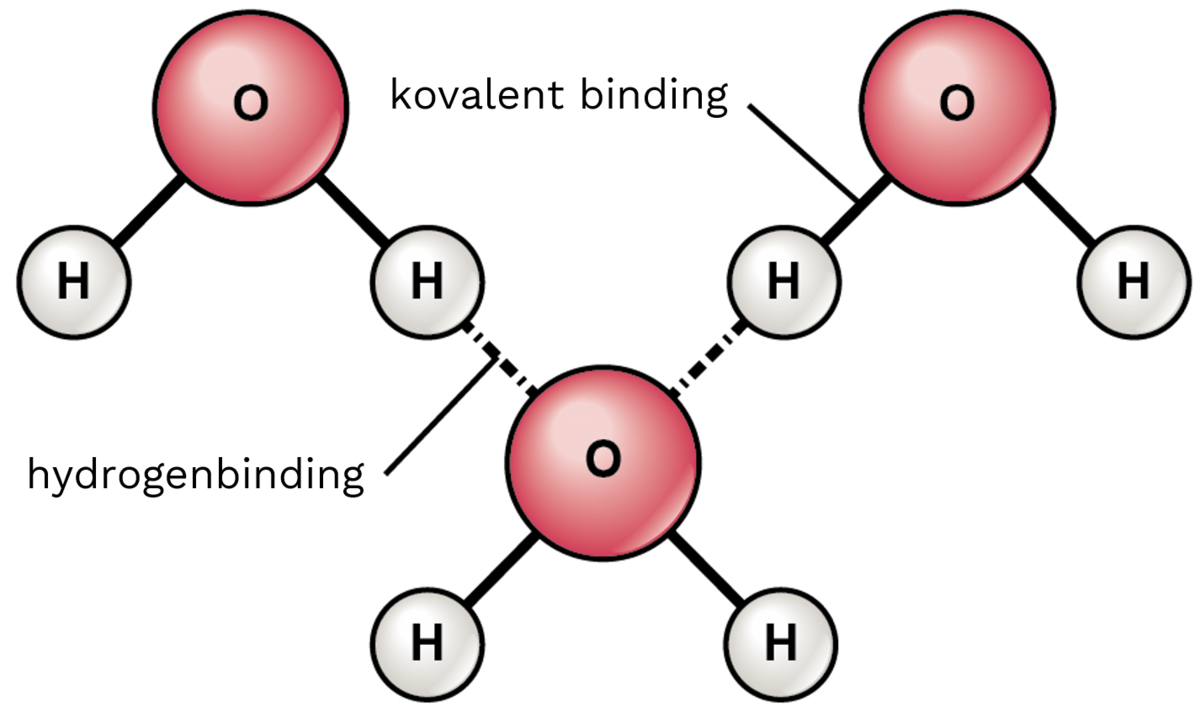
Hydrogenbinding er en viktig type kjemisk binding mellom molekyler. En hydrogenbinding dannes mellom et hydrogenatom på et elektronegativt atom (for eksempel et oksygenatom) og et ledig elektronpar på et annet elektronegativt atom (for eksempel et oksygenatom i et annet molekyl). De to oksygenatomene sies da å være bundet sammen av en hydrogenbinding: –OH...:O-
Faktaboks
- Uttale
- hydrogˈenbinding
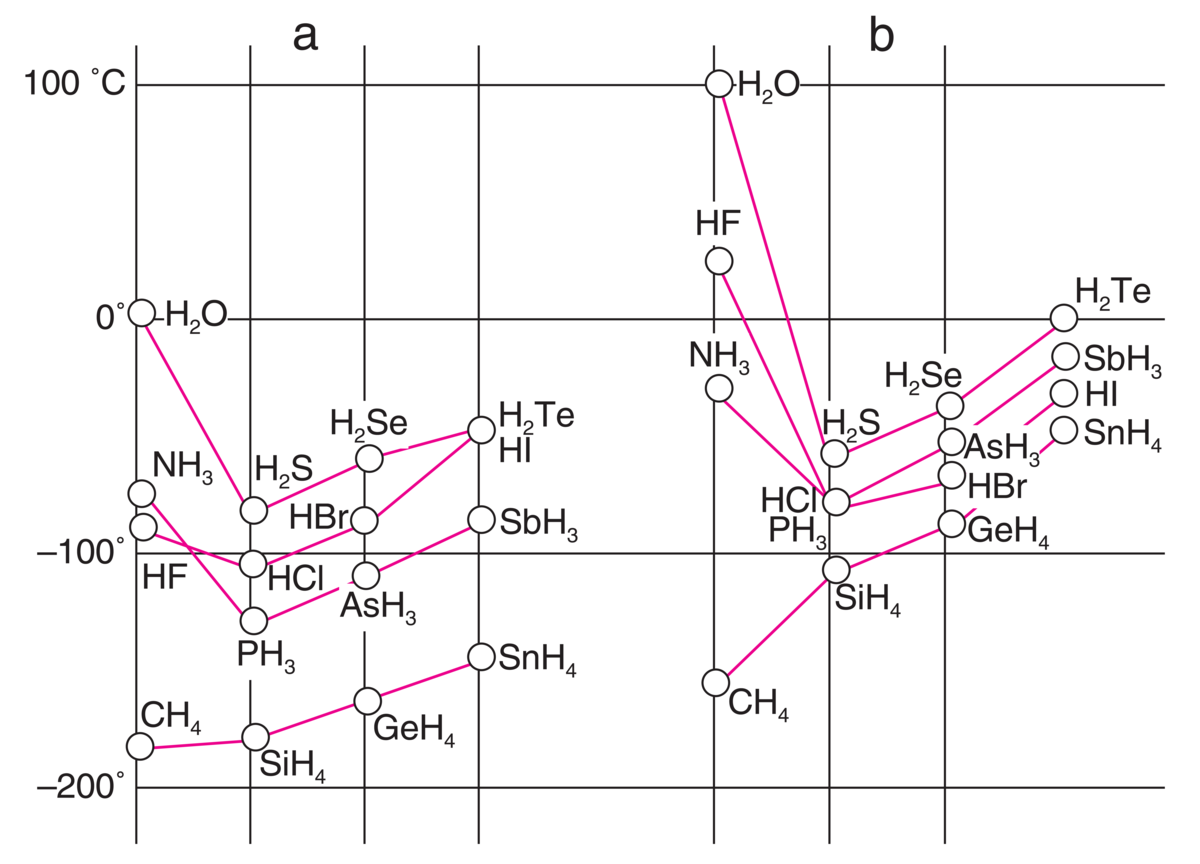
Det er hydrogenbindinger mellom nabovannmolekylene i både is og vann. I DNA er det hydrogenbindinger mellom baseparene. Hydrogenbindinger er også viktige i proteiner og i noen typer plast, som kevlar.





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.