Eit molekyl er ei samling av like eller ulike atom som er bunde til kvarandre med kjemiske bindingar. Det aller minste molekylet som finst er hydrogenmolekylet. Det består av berre to hydrogenatom som er bunde saman, og dette skriv vi med den kjemiske formelen H2 . Dei største molekyla er makromolekyl som kan bestå av fleire tusen atom, som for eksempel cellulosemolekyl i tre eller polyetylenmolekyl i plast.
molekyl
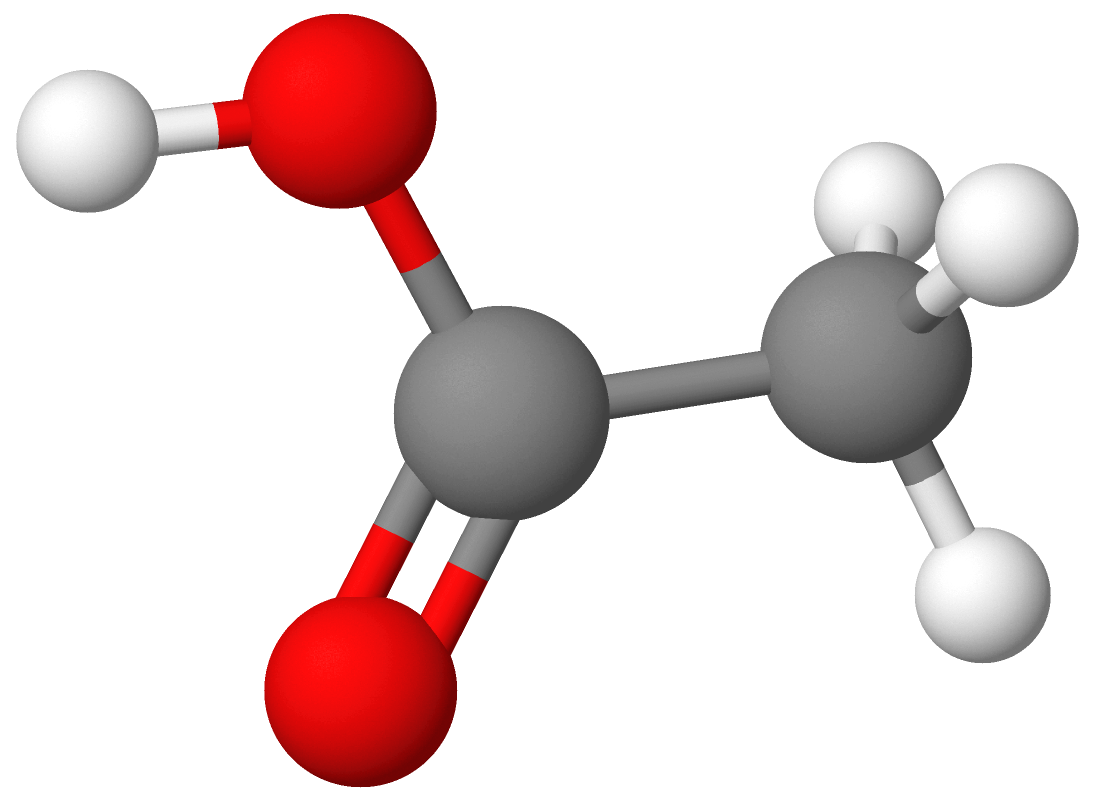
Modell av eddiksyremolekylet. Kvite kuler står for hydrogenatom. Svarte kuler står for karbonatom. Raude kuler står for oksygenatom. Strekane står for kjemiske bindingar.
Kjemiske bindingar i molekyl
Ei forklaring for kvifor atoma held saman i eit molekyl er at det verker tiltrekkande krefter, elektrostatiske krefter, mellom positiv ladning i atomkjernen og negativ ladning i elektronskyene rundt atoma. Desse tiltrekkande kreftene er «limet» som held atoma saman, og er det vi kallar kjemisk binding.
Molekylsambindingar
Stoff som er bygd opp av molekyl kallar vi også molekylsambindingar. Svært mange av stoffa vi omgir oss med i kvardagen er molekylsambindingar. Det gjeld for eksempel gassane nitrogen (N2) og oksygen (O2) i lufta, vatn (H2O), og dei fleste av stoffa i mat og drikke, som sukker, smør og planteoljer, eddik og etanol.
Det er som oftast atom av ikkje-metalliske grunnstoff som dannar molekylsambindingar, som for eksempel karbon (C), nitrogen (N), svovel (S), klor (Cl) og så bortetter. Molekylsambindingar skil seg frå salt og metall ved at molekyla er forholdsvis små og avgrensa, medan salt og metall er bygd opp av gigantstrukturar som strekker seg utover i alle retningar. Molekylsambindingar har som hovudregel nokså lave smelte- og kokepunkt samanlikna med salt og metall. Dette er fordi det verker svake elektrostatiske krefter, også kalla svake bindingar, mellom molekyla.
Bindingar og formlar
Alle molekyl har eit namn og ein kjemisk formel, som fortel kva atom dei består av, og kor mange det er av kvart atom i molekylet. CO2 er den kjemiske formelen for karbondioksid. C står for eitt karbonatom, og O2 fortel at det er to oksygenatom i molekylet. Når mange molekyl hopar seg saman, blir det til slutt eit synleg stoff, til dømes vatn (H2O). Sidan CO2 og H2O er sette saman av ulike atom, kallar vi dei òg kjemiske sambindingar.
Historie
Molekyl (som betyr liten masse) og atom (som betyr udeleleg) er fleire hundre år gamle omgrep. Først på byrjinga av 1800-talet vart omgrepa for alvor tatt i bruk i vitskapen. To pionerar var John Dalton og Amadeo Avogadro. Dalton foreslo relative atommassar av nokre grunnstoff, der atomvekta til hydrogen vart sett til 1. Avogadro foreslo nokre år seinare at i to gassar av to ulike stoff var det like mange molekyl når volum, trykk og temperatur var dei same i begge gassane. Dette vart førti år seinare kalla avogadrolova.
Men framleis visste ingen kor små molekyl er. Det fann ein først ut mot slutten av 1800-talet. Først på 1900-talet kom det metodar (røntgendiffraksjon og massespektrometer) som gjorde at ein kunne kartleggje strukturen til molekyl i detalj og avgjere massen av atom nøyaktig.
Les meir i Store norske leksikon




Kommentarar
Kommentarar til artikkelen blir synleg for alle. Ikkje skriv inn sensitive opplysningar, for eksempel helseopplysningar. Fagansvarleg eller redaktør svarar når dei kan. Det kan ta tid før du får svar.
Du må være logga inn for å kommentere.