Oksidasjonstall er i kjemien et tall knyttet til et atom som er en del av et molekyl eller et ion. Tallet angir hvor mange flere (eller færre) elektroner atomet har i denne forbindelsen sammenlignet med hvor mange elektroner atomet har når det opptrer alene.
Faktaboks
- Uttale
- oksidasjˈonstall
Bindingselektronene blir fordelt på atomene i molekylet eller ionet etter gitte regler, og det er ut fra disse reglene oksidasjonstallet fastsettes.
Oksidasjonstallene skrives som romertall for å skille dem fra andre tall som blir brukt når en kjemisk forbindelse beskrives.
Eksempel: Det finnes to jernklorider der jernatomene har forskjellig oksidasjonstall. I den ene har jernatomet oksidasjonstall II, og i det andre oksidasjonstall III. De to forbindelsene skrives henholdsvis jern(II)klorid, FeCl2, og jern(III)klorid, FeCl3.


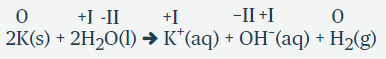


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.