Jern er et metallisk grunnstoff. Det er det teknisk og økonomisk viktigste av alle metallene, spesielt fordi det brukes til å produsere stål. Jernmetaller er en fellesbetegnelse på jern, kobolt og nikkel.
Faktaboks
- Engelsk navn
- iron
- Atomsymbol
- Fe
- Atomnummer
- 26
- Relativ atommasse
- 55,847
Jern spiller en viktig rolle i kroppen. Jern finnes i de røde blodcellene, og det er til dette jernet at oksygen fester seg og blir fraktet rundt i blodet. Et menneske trenger en daglig tilførsel av 5–20 mg jern gjennom maten.
- Les mer om jern – fysiologi.
Rent jern er sølvhvitt, relativt mykt, magnetisk og lett å bearbeide. Jern forekommer rent i naturen og det finnes veldig mye av det, både på Jorden og i resten av universet. Jern reagerer lett med oksygen og ruster (korroderer). Derfor brukes det mest i form av stål, som ikke ruster så lett.
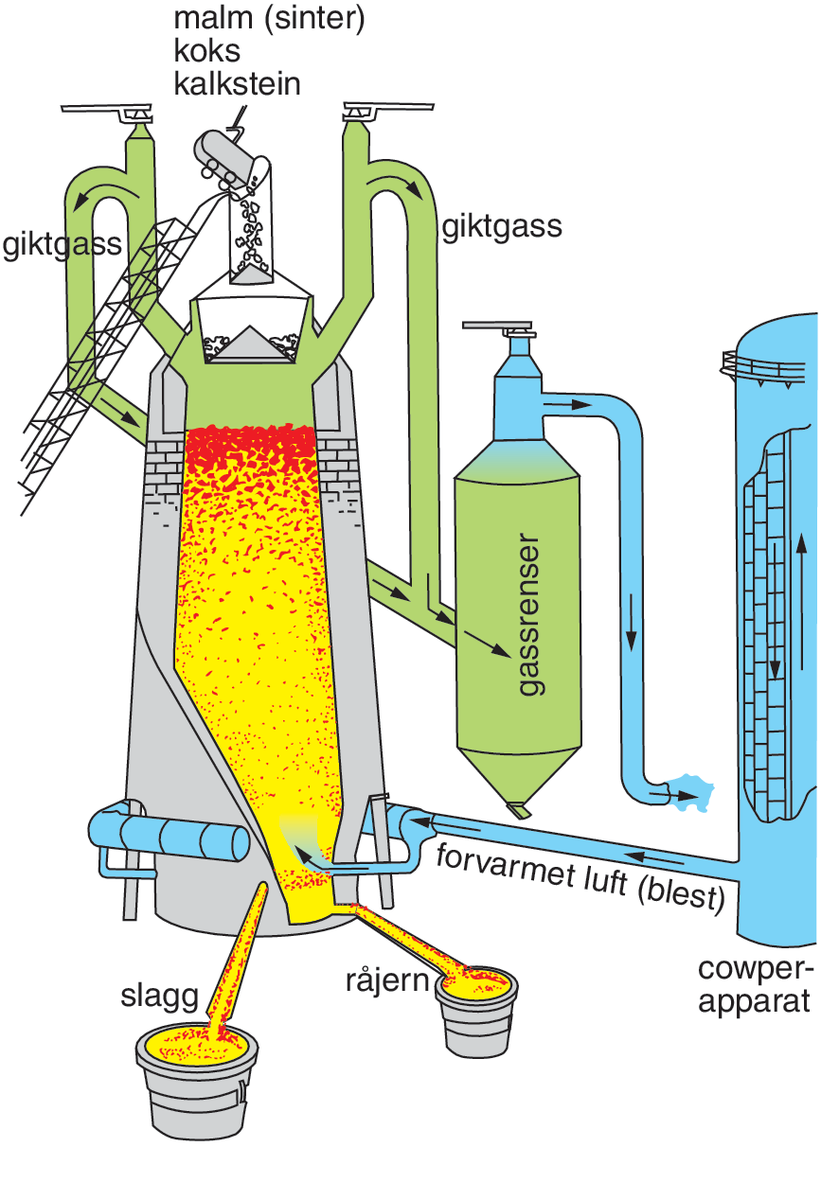
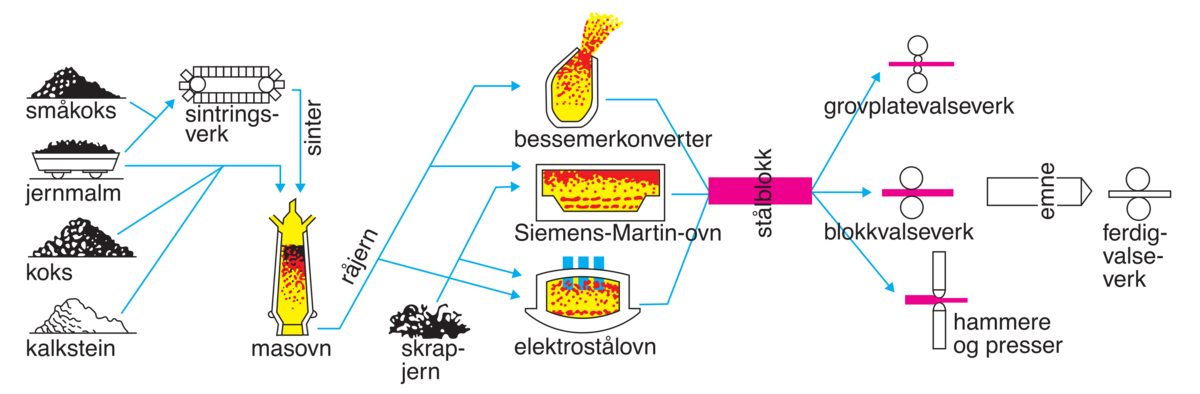
Kunnskapen om hvordan man utvinner jern ble utviklet i Lilleasia rundt 1300–1200 år fvt. og spredte seg via Egypt til Europa. Dette var starten på jernalderen.






Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.