Fosfor er et grunnstoff som har atomnummer 15 og atomsymbol P. Fosfor er viktig for alt liv, og finnes blant annet i beinvev, i arvestoffet DNA, og i ATP, som er viktig i energiomsetningen i kroppen. Fosfor er det andre grunnstoffet i gruppe 15 (nitrogengruppen) i periodesystemet.
Faktaboks
- Uttale
- fˈosfor
- Engelsk navn
- phosphorus
- Atomnummer
- 15
- Relativ atommasse
- 30,973
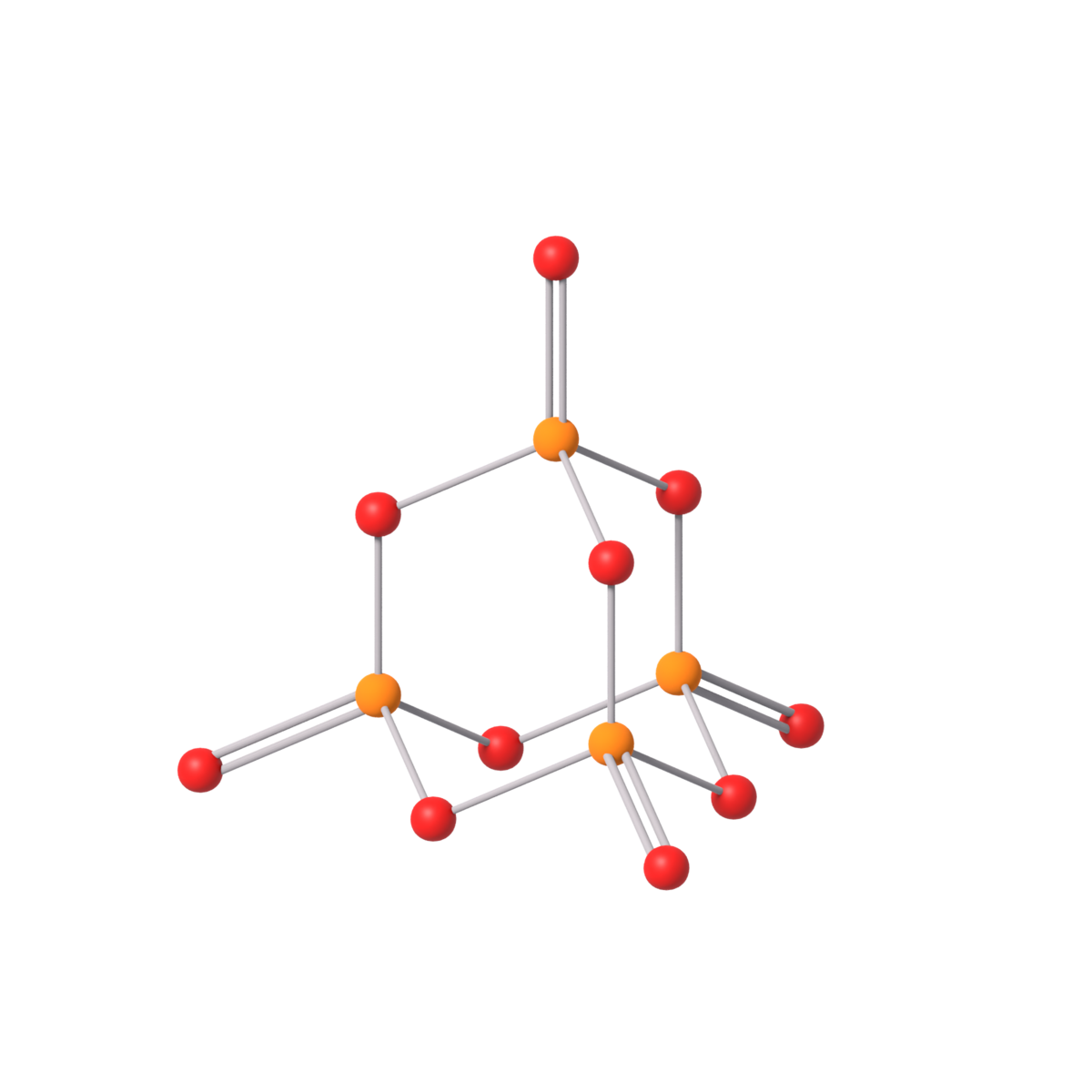
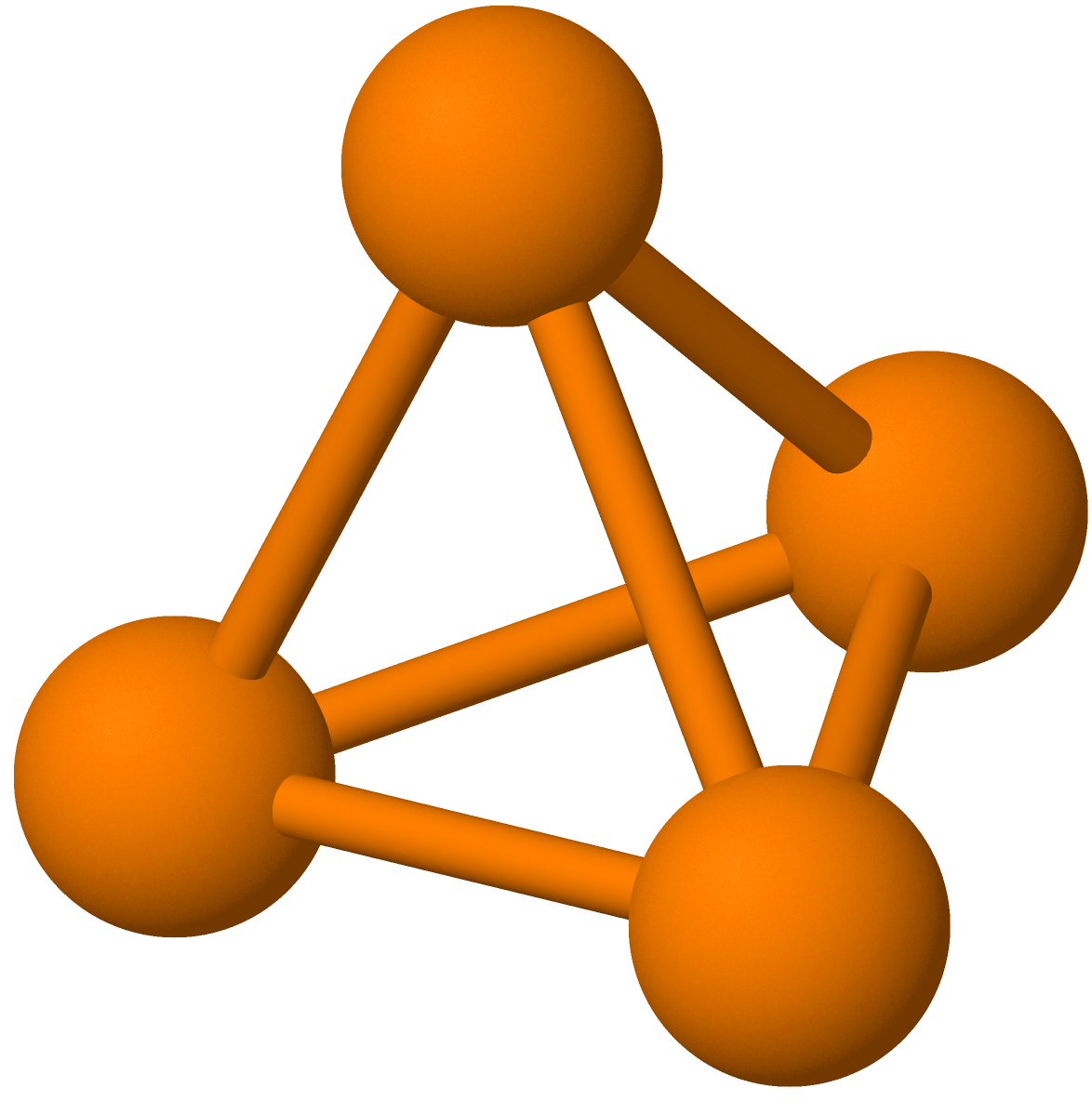
Fast fosfor finnes i tre allotropiske former med svært forskjellige egenskaper: hvitt fosfor, rødt fosfor og svart fosfor.
- Hvitt fosfor dannes når fosfor i væskeform stivner.
- Rødt fosfor dannes ved bestråling av hvitt fosfor med ultrafiolett lys.
- Sort fosfor dannes først under høyt trykk.
Det er bare én stabil isotop av fosfor: 31P. Den radioaktive isotopen 32P, som har en halveringstid på 14,3 dager, blir brukt som radioaktivt sporgrunnstoff.






Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.