Innånding av manganstøv gjennom lengre tid kan forårsake en kronisk manganforgiftning, som skader basalgangliene i hjernen og gir symptomer av samme type som ved Parkinsons sykdom. I begynnelsesstadiet gir manganforgiftning slapphet, søvnproblemer og av og til talevansker.
Mangan kan også skade cellene i luftveiene og gi økt risiko for utvikling av lungebetennelse. Tilstanden ble første gang beskrevet i Sauda i 1939 av den norske legen Dagfinn Elstad.
Det er store individuelle variasjoner med hensyn til følsomheten for mangan, og i forgiftningens tidlige stadier kan pasienten bli helt frisk igjen hvis han kommer bort fra det forurensede miljøet. Mangan inngår ikke sjelden i sveiseelektroder, og muligheten for forgiftning er størst hvis sveisingen foregår i trange rom, slik at konsentrasjonen blir stor.
Mangan er av betydning for en rekke enzymprosesser i kroppen. Vanlig kost tilfører nok mangan, og symptomer på manganmangel er ikke kjent hos mennesker.
Mangan finnes nesten over alt i jordsmonnet. Et høyt manganinnhold i jordsmonnet kan imidlertid katalysere oksidering av jern til treverdig, og dermed gjøre jernet utilgjengelig for planter.
Mangan er et livsnødvendig sporgrunnstoff i planter, dyr og mennesker. Alle celler inneholder små mengder mangan. Det er en nødvendig bestanddel av flere enzymer. I plantene katalyserer mangan dannelsen av klorofyll. I menneskekroppen er mangan særlig konsentrert i vev, knokler, lever og lymfeknuter.
Ved normalt kosthold får kroppen tilført ca. 2,10 mg mangan per dag.








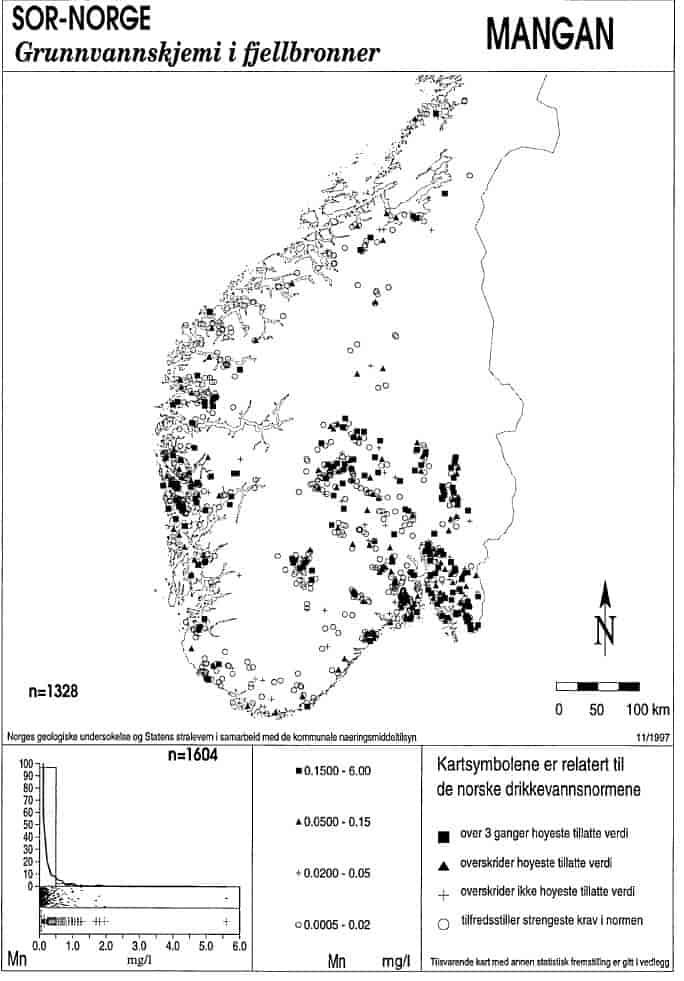


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.