Karbonater er innen kjemi salter av karbonsyre hvor begge hydrogenatomene i karbonsyre er erstattet med kationer. Alkalimetallenes karbonater, unntatt litiumkarbonat, løses lett i vann.
Faktaboks
- Uttale
- karbonˈater
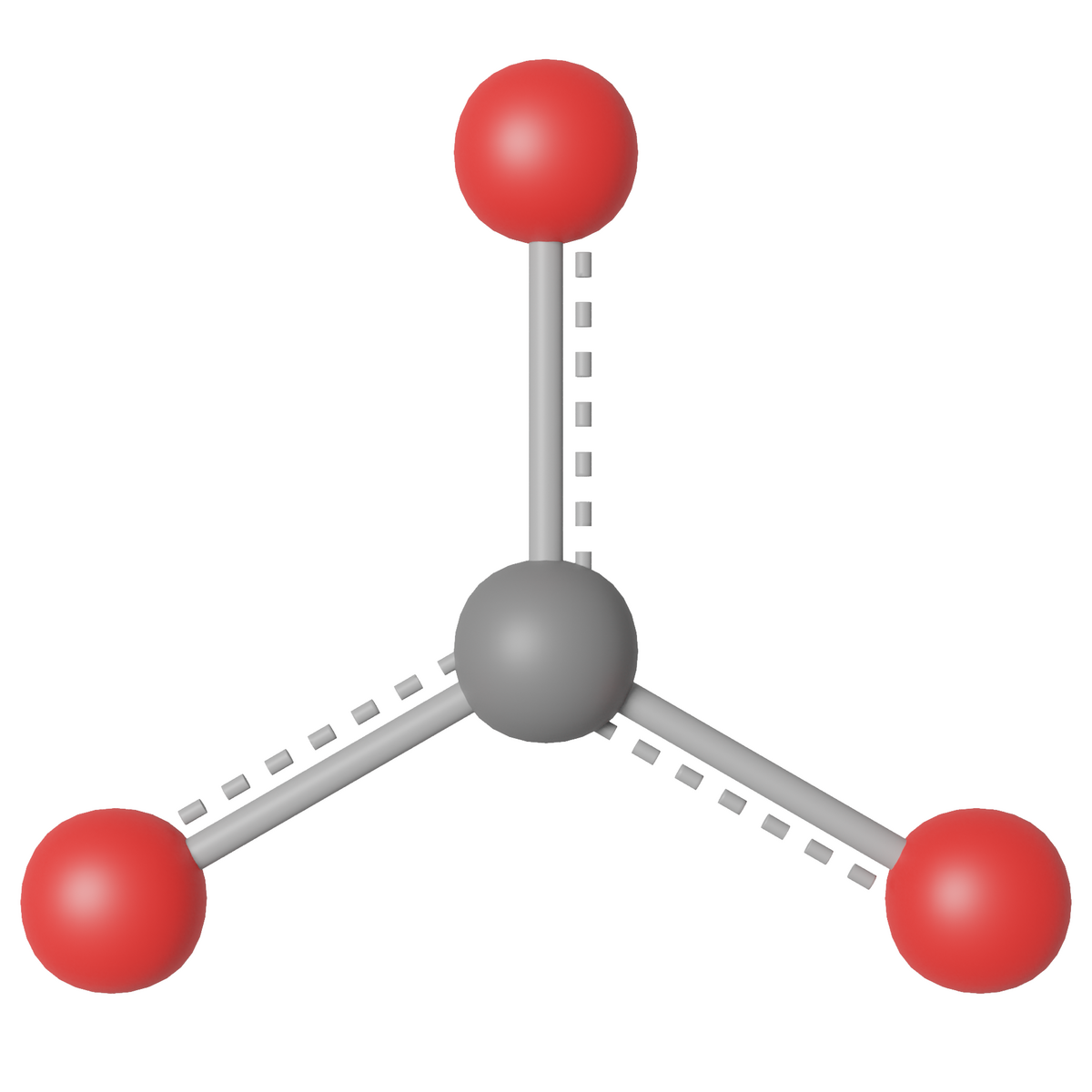
Karbonationet, med kjemisk formel CO32−, er plant og isolelektronisk med nitrationet.
I naturen forekommer store mengder kalsiumkarbonat, CaCO3 i form av mineralene kalsitt og aragonitt. De danner bergartene kalkstein, marmor og kritt. Noen andre eksempler på mineraler som er karbonater, er magnesitt, sideritt, rhodokrositt og smithsonitt. Karbonatene soda og pottaske fremstilles industrielt.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.