Svovelsyre er en syre. Ren svovelsyre er en fargeløs, viskøs, oljeaktig, luktfri væske som fryser ved 10 grader celsius.
Faktaboks
- Også kjent som
-
acidum sulfuricum
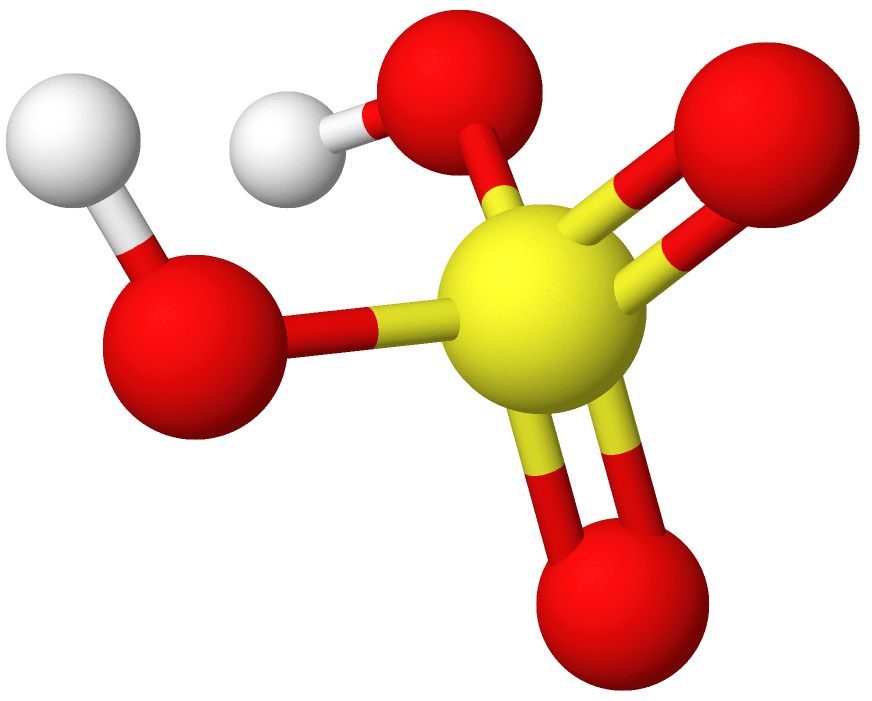
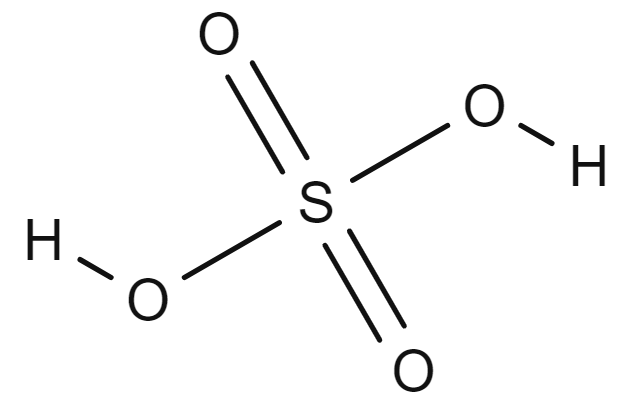
Bruttoformelen til svovelsyre er H2SO4 og strukturformelen (HO)2SO2. Det kjemiske navnet på svovelsyre er hydrogensulfat.
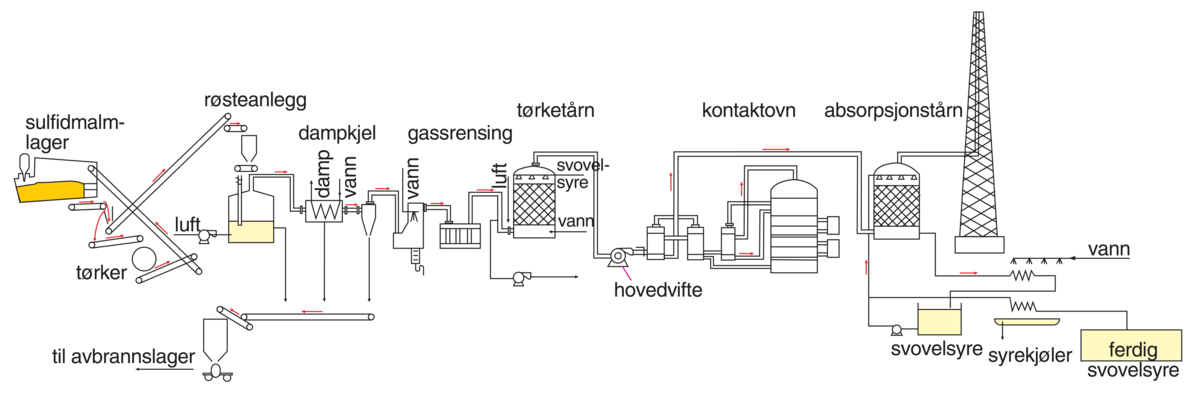
Svovelsyre er det kjemikaliet som det fremstilles mest av i verden. Det brukes blant annet i produksjon av kunstgjødsel og til fremstilling av andre syrer.
Når konsentrert svovelsyre løses i vann, blir løsningen svært varm; reaksjonen er eksoterm. Det er derfor viktig å aldri helle vann i svovelsyre når syren skal blandes med vann, men helle syren forsiktig i vannet.
Svovelsyre forekommer i noen varme kilder i Colombia, i Tennessee og på Java, hvor den blir dannet ved reaksjon mellom overhetet vanndamp og jern(II)sulfat. Saltene av svovelsyre foreligger i naturen i form av tallrike sulfater. Planter og dyr inneholder løste sulfater, og for plantenes vekst er et visst innhold av sulfater i jorden nødvendig (se svovel).





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.