Karbondioksid er en kjemisk forbindelse som er en gass ved romtemperatur. Den er viktig for klimaet på Jorden og for grønne planter.
Faktaboks
- Norsk navn
- karbondioksid
- Engelsk navn
- carbon dioxide
- Også kjent som
-
CO2, CO2, kullsyre (i vann)
- Uttale
- karbˈondiåksˈid
- Kjemisk formel
-
CO₂
- Stoffklasse
- uorganisk molekyl
- E-nummer
- E 290
- Smeltepunkt
- –78,5 °C (sublimerer)
- Kokepunkt
- –78,5 °C (sublimerer)
- Tilstand
- gass
Karbondioksid dannes ved forbrenning i kroppen til mennesker og dyr, og ved andre forbrenningsprosesser. I fotosyntesen reduseres karbondioksidgass og vann av grønne planter og sollys til oksygengass og karbohydrater.
Karbondioksid løser seg lett i vann og danner karbonsyre, som tidligere ble kalt kullsyre.



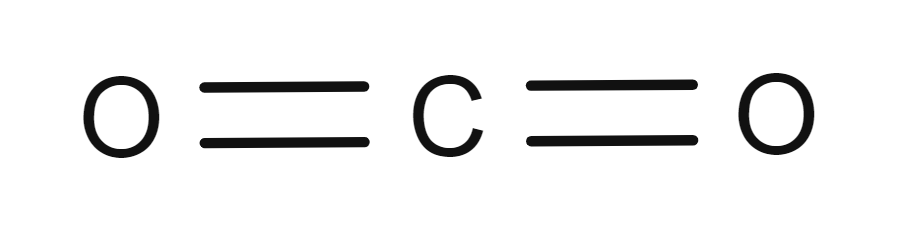



Kommentarer (8)
skrev Svein Askheim
skrev Sivert Sæterbø
svarte Svein Askheim
skrev Tore Musken
svarte Bjørn Pedersen
skrev Fredrik Klouman
Under Menneskelig innvirkning står: «Ved forbrenning av kull, petroleum og naturgass blir atmosfæren årlig tilført ca. 6 milliarder tonn karbondioksid, og ved nåtidens intensive landbruk ca. 2 milliarder tonn.» Jeg mistenker at tallene gjelder mengde karbon, ikke karbondioksid. Dessuten er ikke årstall angitt. Jeg anmoder om at dette oppdateres.
skrev Audun Brandsæter
Noe av det som står under «Fysiologisk virkning» kan være misvisende eller gi grunnlag for misforståelser.
Også hos mennesker styres pustefunksjonen av CO2-innholdet i blodet. For høy konsentrasjon av karbondioksid i innåndingsluften har skadevirkinger for både dyr og mennesker, og skadevirkningene er ikke bare basert på fortrengning av oksygenet i luften.
Høy konsentrasjon av karbondioksid påvirker autonome reflekser som styrer åndedrettet. I første omgang kan det gi hyperventilering, men i verste fall kan åndedrettet opphøre. Og så vidt jeg har forstått kan man ikke da «vaske ut» karbondioksidet og forhindre skade bare med frisk luft eller oksygentilførsel.
Selv om det muligens ikke passer med definisjonen av «giftig», kan det derfor gi grunnlag for farlige misforståelser å hevde at «CO2 er ikke i seg selv giftig».
svarte Anne Eilertsen
Takk for kommentaren din! Vi har nå fått en av våre fagansvarlige innen medisin til å skrive et litt grundigere avsnitt om akkurat dette.
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.