Salpetersyre er en sterk syre som blant annet brukes til fremstilling av kunstgjødsel og sprengstoff.
Faktaboks
- Norsk navn
- salpetersyre
- Engelsk navn
- nitric acid
- Også kjent som
-
nitrogen(V)syre, aqua fortis, acidum nitricum. Engelsk nitric acid, fransk acide nitrique, tysk Salpetersäure
- Uttale
- salpˈetersyre
- Etymologi
-
salpeter fra middelalderlatin salpetra, sal petrae, grunnbetydning 'klippesalt'
- Kjemisk formel
-
HNO3
- Stoffklasse
- sterk syre
- Smeltepunkt
- –41,6 °C
- Kokepunkt
- 83 °C
- Tilstand
- væske, oftest i løsning sammen med vann
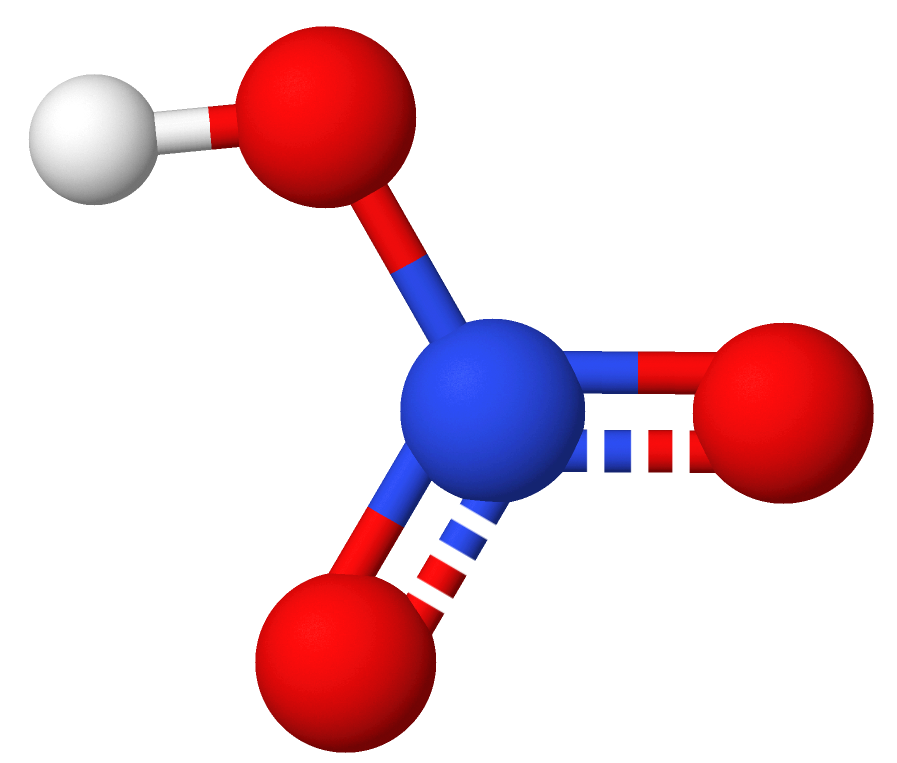
Salpetersyre er den mest bestandige og viktigste av oksosyrene til nitrogen. Den er en sterk, etsende syre og selges løst i vann i forskjellige konsentrasjoner. Salpetersyre må håndteres med stor forsiktighet, ikke bare fordi den er en sterk syre, men fordi den er et sterkt oksidasjonsmiddel.
Syren har bruttoformel HNO3 og strukturformel HONO2. Salter av salpetersyre kalles nitrater, etter engelsk nitric acid.





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.