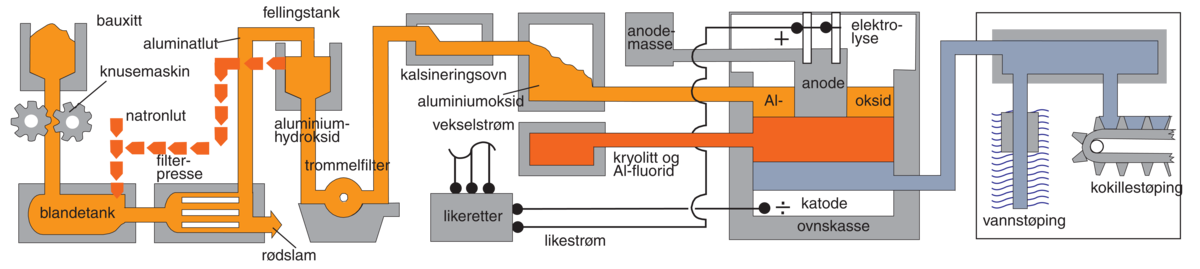
Aluminium og aluminiumlegeringar blir brukt i transport- og kommunikasjonsmiddel (bilar, bussar, jernbane- og sporvogner, fly, skip og så vidare), i bygningsindustrien til tak- og veggkledning og berande profilar, og til innreiingar og dekorative formål. I form av foliar blir aluminium nytta som emballasjemateriale (tubar, boksar, kapslar, lokk, innpakningsmateriale), som tråd til elektriske leidningar og kablar, og som plater til framstilling av eit utal av bruksgjenstandar, hushalds- og kjøkkenutstyr, kar og behaldarar til bruk i næringsmiddelfabrikkar, meieri, bryggjeri og så vidare.
Aluminiumpulveret si brennbarheit blir nytta ved aluminotermisk framstilling av metall og ved sveising etter termittmetoden. Termitt er ei blanding av aluminiumpulver og jernoksid. Ved påtenning reagerer aluminium med jernoksidet under danning av jern, og samtidig blir det utvikla så sterk varme at jernet smeltar. På same prinsipp byggjer aluminotermisk framstilling av metall som krom, mangan, vanadium med fleire. Brannbomber inneheld òg termitt i blanding med andre brennbare stoff. Aluminium blir dessutan nytta i fyrverkeri-industrien og i aluminiumsmåling.
Aluminium er tillatt som fargestoff i kakepynt, men er langt på vei erstatta av sølv. Aluminium har E-nummer E 173.
International Resource Panel, eit ekspertpanel oppretta av FN, rekta i 2010 mengda aluminium i bruk i verda til 80 kg per innbyggjar.










Kommentarar (9)
skreiv Ketil Rye
skreiv Bjørn Pedersen
skreiv Leif Sletvold
skreiv Svein Askheim
skreiv Leif Sletvold
svarte Erik Dyrhaug
skreiv Svein Askheim
skreiv Jonas Låstad
Se verdensproduksjonen i kapittelet om forekomst og siste avsnittet i fremstillingsmåte. Det virker ikke logisk at verdensproduksjonen i 2017 er 1/6 av Norgesproduksjonen i 2014.
svarte Guro Djupvik
Hei, Jonas.
Takk for oppmerksom lesning, her har noe gått galt. Jeg har fjernet den påstanden som åpenbart er feil og bedt fagansvarlig om å oppdatere artikkelen.
Vennlig hilsen Guro Djupvik, redaktør
Kommentarar til artikkelen blir synleg for alle. Ikkje skriv inn sensitive opplysningar, for eksempel helseopplysningar. Fagansvarleg eller redaktør svarar når dei kan. Det kan ta tid før du får svar.
Du må være logga inn for å kommentere.