Faktaboks
- Uttale
- komplˈeksforbindelser
Et kompleksion består at et sentralt ion som er omgitt av ligander. Ligandene kan være nøytrale molekyler eller ioner. Kompleksforbindelser kalles også koordinasjonsforbindelser fordi ligandene sies å være koordinert, det vil si bundet, til det sentrale ionet.
Strukturen til disse forbindelsene var en utfordring for kjemikere helt til Alfred Werner foreslo i 1890-årene en struktur for dem som viste seg å være riktig.
Det sentrale ionet i et kompleksion er en lewissyre, og ligandene er lewisbaser (se syrer). Det sentrale ionet er vanligvis fra d-blokken.
De enkleste kompleksionene har fire eller seks ligander. Ligandene kan være ioner som F–, Cl–, Br–, I– OH–, CN– eller molekyler som NH3 ogH2O eller H2N·CH2·CH2·NH2 hvor begge NH2-gruppene kan være koordinert til det sentrale ionet (se chelater).
NO3- (nitrat), SO42– (sulfat), Cr2O72+(dikromat), PO43– (fosfat), og stoffer som inneholder dem, kalles ikke kompleksforbindelser.
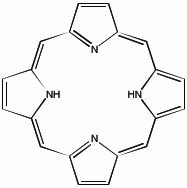
Porfyrin
I kompleksforbindelsen kaliumheksacyanidoferrat(II) (trivialnavn gult blodlutsalt), K4[Fe(CN)6], finnes kompleksionet [Fe(CN)6]4−. Sentralatomet er jernionet Fe2+, ligandene er seks cyanidioner CN−. Kompleksionets ladning blir da + 2 − 6 = − 4.
Antall ligander som omgir sentralatomet angis ved koordinasjonstallet. I K4[Fe(CN)6] har jern koordinasjonstallet 6, og cyanidionene ligger i hjørnene av et oktaeder.
Et berømt eksempel på en ligand er porfyrin. Når de to H-atomene avgis som H+-ioner kan ringene binde et Mg2+-ion. Denne kompleksforbindelsen er sentral i klorofyll.
Sentralionet i kompleksforbindelser er ioner til grunnstoffene i d-blokken som krom, mangan, jern, kobolt, nikkel og kobber. Ikke-metaller kan også danne kompleksforbindelser. Et eksempel er kaliumtetrafluoridoborat, K[BF4], med det komplekse tetrafluoridoborationet [BF4]−. I dette ionet sitter fluoridionene i hjørnene på et tetraeder.
Kompleksforbindelser av ioner av grunnstoffene i d-blokken og løsninger av disse er oftest farget. I vann kan ligandene skiftes ut ved tilsetting av andre ioner/molekyler til løsningen og/eller ved oppvarming. Kompleksene skifter da ofte farge.
Et eksempel: [Co(H2O)6]2+(aq) + 4Cl-(aq) ⇋ [CoCl4]2-(aq) + 6H2O(l)
Det første komplekset (aquakomplekset) er lyserødt, og det andre (kloridkomplekset) er blått. Først løser vi koboltklorid i vann, og da blir løsningen lyserød. Så tilsetter vi saltsyre til løsningen. Da forskyves likevekten til høyre, og løsningen blir blå. Fargen skyldes overgang mellom energinivåer i Co2+-ionet. Overgangen, og dermed fargen, påvirkes av ligandene.
Kompleksforbindelser brukes til mange formål. I analytisk kjemi brukes de til å skille, bestemme eller også til å kamuflere forskjellige metaller. Om titrimetrisk bestemmelse av metaller ved hjelp av kompleksforbindelser, se kompleksoner.
Også for atskillelse og renfremstilling av metaller ved ekstraksjon, for eksempel av de sjeldne jordartsgrunnstoffene, benytter man seg av kompleksforbindelser, og det samme gjelder ved elektrolytisk fremstilling av metaller. I fargerier, i garverier, ved forgiftninger, for å bestemme og fjerne hardhet og forurensninger i vann med mer finner også kompleksforbindelser anvendelse (se også chelatkomplekser og EDTA).
I biokjemien spiller kompleksforbindelser en særlig viktig rolle. Klorofyll inneholder som nevnt magnesium, og hemoglobin inneholder jernioner bundet i chelater. Mange livsviktige enzymer er metallkomplekser. Et eksempel er vitamin B12, som inneholder et koboltion som sentralatom (se vitaminer).

Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.