Zeolitter er vannholdige aluminiumsilikater av natrium eller kalsium, sjeldnere kalium, barium eller strontium. Zeolitter finnes som mineraler i naturen, men kan også fremstilles syntetisk. Det som først og fremst skiller zeolitter fra andre mineraler, er at de er mikroporøse, med porer fra 0,3 til 0,8 nanometer (nm).
zeolitter


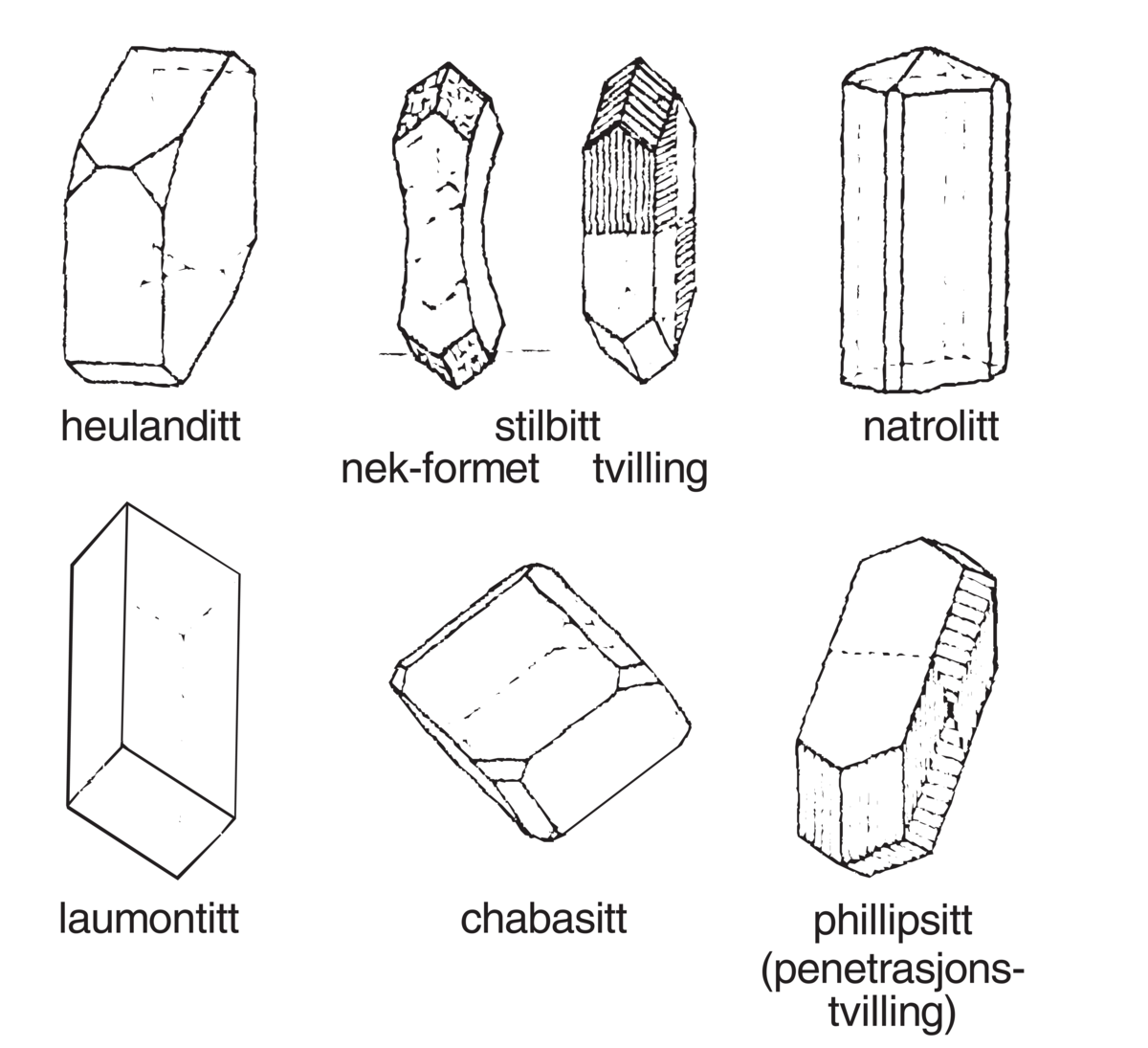
Zeolitter. Typiske krystallformer for en del vanlige zeolittmineraler.
Struktur og egenskaper
Zeolitter er vanligvis fargeløse, hvite eller lyst farget og har en sterk glassaktig til perlemoraktig glans. Massetettheten ligger mellom 2,1 og 2,5 g/cm3 og hardheten mellom 4 og 5,5.
Strukturelt sett tilhører de nettverksilikatene (se silikatmineraler), det vil si at de er bygd opp av SiO4- og AlO4-tetraedre som danner et nokså åpent, tredimensjonalt nettverk med store hulrom og kanaler. I disse hulrommene sitter det ioner av alkali- eller jordalkalimetaller samt vannmolekyler. Vannet er løst bundet og unnviker ved forholdsvis lav temperatur uten at strukturen forandres. Prosessen er reversibel slik at mineralet lett kan oppta vann igjen. Dessuten kan både gasser og organiske molekyler absorberes i slike delvis vannfrie zeolitter. Også metallionene er lett bevegelige og kan erstattes av andre kationer ved behandling med egnede løsninger (ionebytteregenskaper).
Forekomst og dannelse
Det kjennes over 80 forskjellige zeolitter i naturen. Zeolittmineraler dannes fra vandige løsninger ved relativt lave temperaturer (ved senmagmatisk, hydrotermal virksomhet) og er meget utbredt på hulrom i forskjellige bergarter, særlig i basalter, hvor de kan opptre i vakre krystaller.
Zeolitter finnes også på sprekker og mineralganger i en rekke bergarter. Videre dannes zeolitter under regionalmetamorfose ved lav temperatur og lavt trykk i såkalt zeolittfacies (se mineralfacies). Zeolitter kan dessuten oppstå sekundært ved omvandling av andre aluminiumsilikater (feltspater og feltspatoider).
Zeolitter opptrer ofte i store mengder i tuffbergarter og andre sedimentære bergarter, der de er dannet ved diagenese (særlig analcim, klinoptilolitt, heulanditt, laumontitt og phillipsitt). Det har vist seg at også dyphavssedimenter kan inneholde store mengder zeolitter (for eksempel phillipsitt og klinoptilolitt).
Syntetiske zeolitter kan dannes ved direkte syntese eller gjennom endring av naturlige zeolitter.
Bruksområder
Den praktiske bruken av zeolitter beror på deres spesielle egenskaper når det gjelder absorpsjon, ionebytting, dehydratisering og filtervirkning. Både syntetiske og naturlige zeolitter har utstrakt bruk i industrien, blant annet til cracking av olje til bensin, separasjon av luft til nitrogen og oksygen, tørking av gass og rensing av vann.
Vaskemidler
Zeolitter blir brukt i fosfatfrie vaskemidler der zeolitten bidrar til bløtgjøring av vannet ved å binde kalisiumioner og magnesiumioner gjennom utbytting med sine natriumioner. I volum er dette i dag den største anvendelsen med over 400 000 tonn/år.
Tørkemidler
Zeolitter brukes som tørkemiddel, da de på grunn av sin porøse natur lett absorberer vann fra sine omgivelser. I deodoranter, luftrensere, kattesand og papirbleier virker zeolitten både som tørkemiddel og luktfjerner. Zeolitt anvendes også som tilsetning til dyrefôr, der ionebytteregenskapene bidrar til å fjerne ammonium fra fordøyelsessystemet, mens for eksempel kalsium frigis. På lignende måte kan innhold av radioaktivt strontium hos dyr minskes ved bruk av zeolitt i fôret.
Det finnes en rekke andre mulige fremtidige anvendelsesområder, for eksempel kan zeolitter vise seg å bli av betydning i Norge som lagrings- og transportmedium for naturgass og hydrogen, og det drives en utstrakt forskning på zeolitter.
De viktigste naturlige zeolittene
| Mineral | Kjemisk formel |
|---|---|
| Analcim | NaAlSi2O6 · H2O |
| Brewsteritt | (Sr,Ba,Ca)Al2Si6O16 · 5H2O |
| Chabasitt | CaAl2Si4O12 · 6H2O |
| Erionitt | (K2,Na2)4Al8Si28O72 · 28H2O |
| Faujasitt | (Ca,Na2)2Al4Si8O24 · 16H2O |
| Gismondin | CaAl2Si2O8 · 4H2O |
| Gmelinitt | (Na2,Ca)Al2Si4O12 · 6H2O |
| Gonnarditt | Na2CaAl4Si6O20 · 7H2O |
| Harmotom | (Ba,K2)Al2Si6O16 · 6H2O |
| Heulanditt | (Ca,Na)2–3Al3(Al,Si)2Si13O36 · 12H2O |
| Klinoptilolitt | (Na,K,Ca)2-3Al3(Al,Si)2Si13O36 · 12H2O |
| Laumontitt | CaAl2Si4O12 · 4H2O |
| Mesolitt | Na2Ca2Al6Si9O30 · 8H2O |
| Mordenitt | Na2Al2Si10O24 · 7H2O |
| Natrolitt | Na2Al2Si3O10 · 2H2O |
| Phillipsitt | (K,Na,Ca)1-2(Si,Al)8O16 · 6H2O |
| Pollucitt | (Cs,Na)2Al2Si4O12 · H2O |
| Skolesitt | CaAl2Si3O10 · 3H2O |
| Stilbitt | (Ca,Na2)5Al10Si26O72 · 28H2O |
| Thomsonitt | NaCa2 Al5Si5O20 · 6H2O |


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.