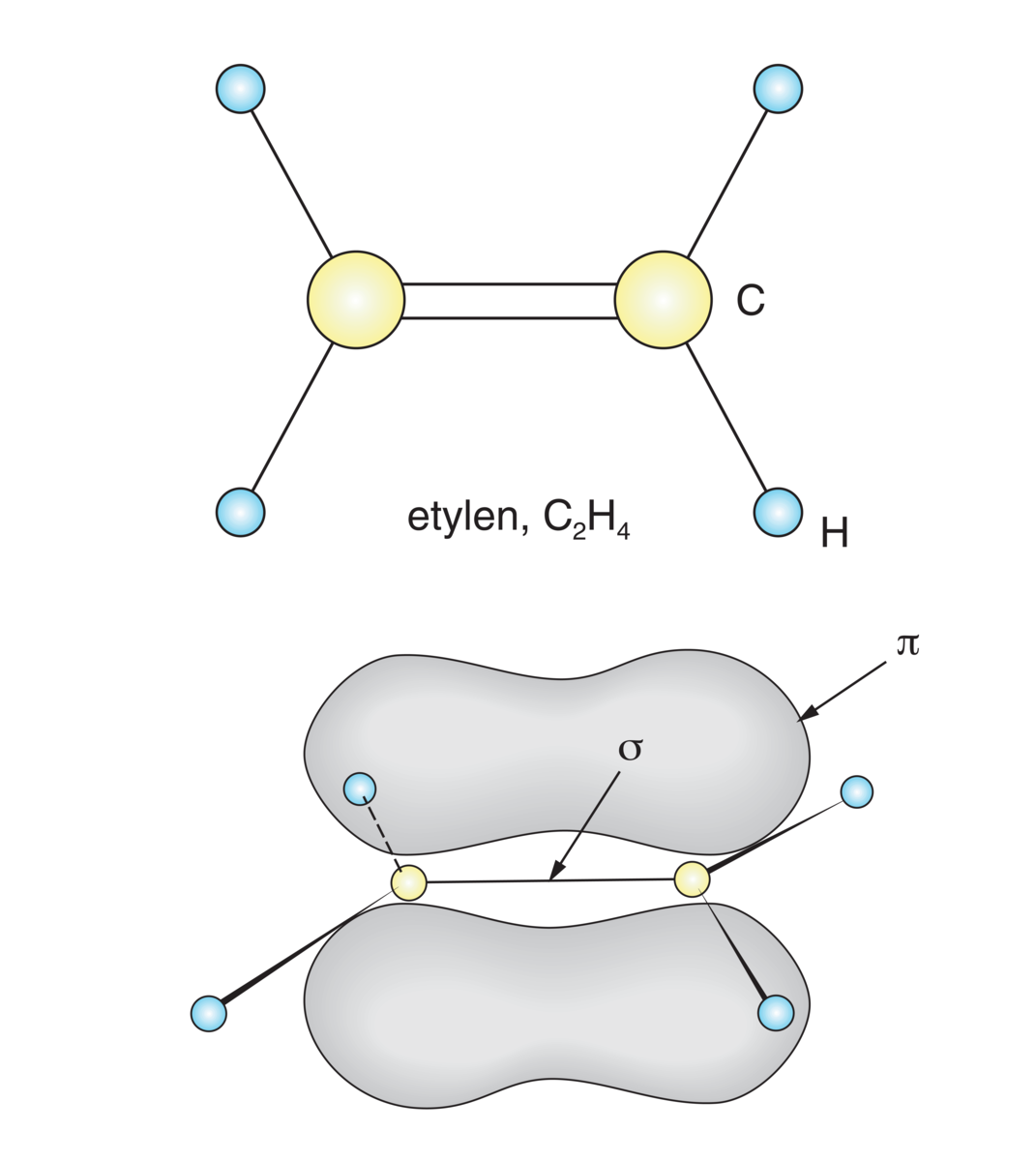
Dobbeltbinding er en kovalent binding mellom to atomer som deler to elektronpar. Dette kan illustreres i en modell ved å trekke to linjer mellom de to atomene.
Avstanden mellom de to atomene i en dobbeltbinding er 15–20 prosent kortere enn avstanden mellom de to samme atomene i en enkeltbinding. (I en enkeltbinding deler de to atomene bare ett elektronpar.) To atomer i en dobbeltbinding er også mer reaktive enn de samme to atomene i en enkeltbinding.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.