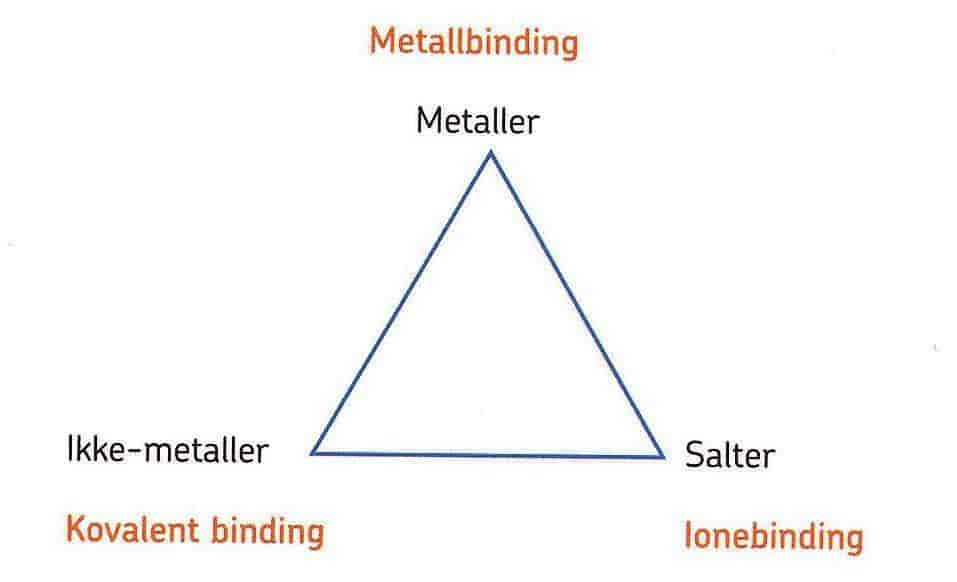
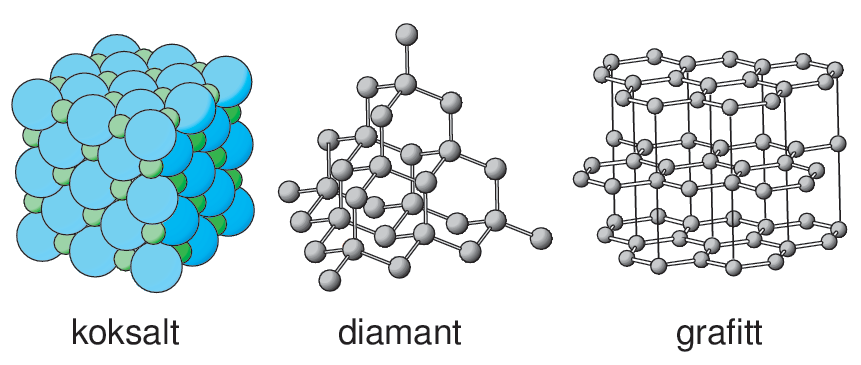
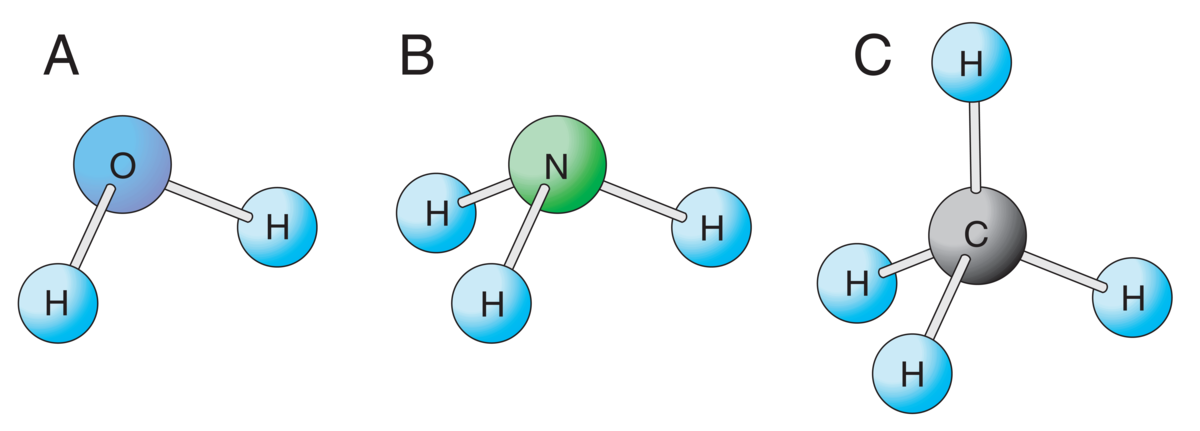
Kjemiske bindinger er kreftene eller «limet» som holder partikler sammen i stoffer. Partiklene kan være atomer, ioner eller molekyler.
Alle kjemiske bindinger oppstår på grunn av tiltrekning mellom positive og negative ladninger. Slik tiltrekning kalles elektrostatisk tiltrekning. Hvor sterk en kjemisk binding er vil avhenge av størrelsen på denne tiltrekningen.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.