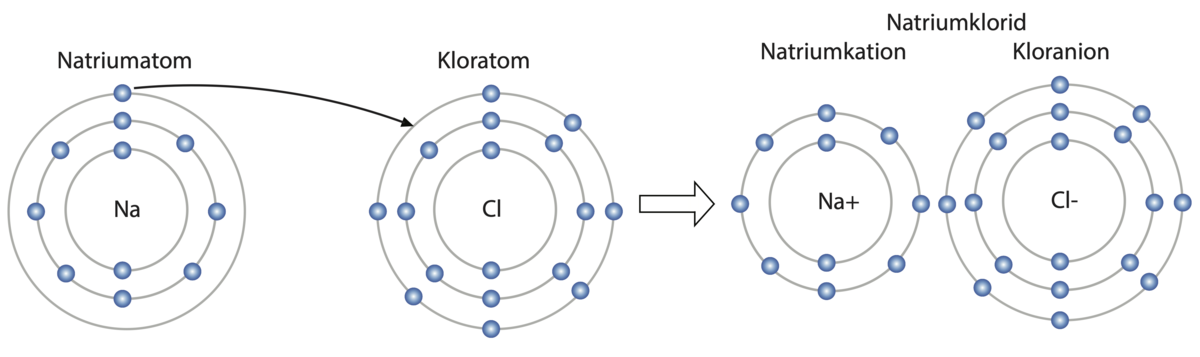
Ionebinding er den kjemiske bindingen mellom to ioner med motsatt ladning. Ionebindinger finnes i salter.
Faktaboks
- Uttale
- iˈonebinding
Den reneste ionebindingen har man mellom atomer med stor forskjell i elektronegativitet, for eksempel i alkalihalogenidene, som natriumklorid og litiumfluorid. Mer generelt finnes ionebindinger mellom et kation til et metall (som har lav elektronegativitet) og et anion til et ikke-metall (som har høy elektronegativitet). Den mest ekstreme ionebindingen er mellom kationet Cs+ og anionet F– i cesiumfluorid, som har kjemisk formel CsF.
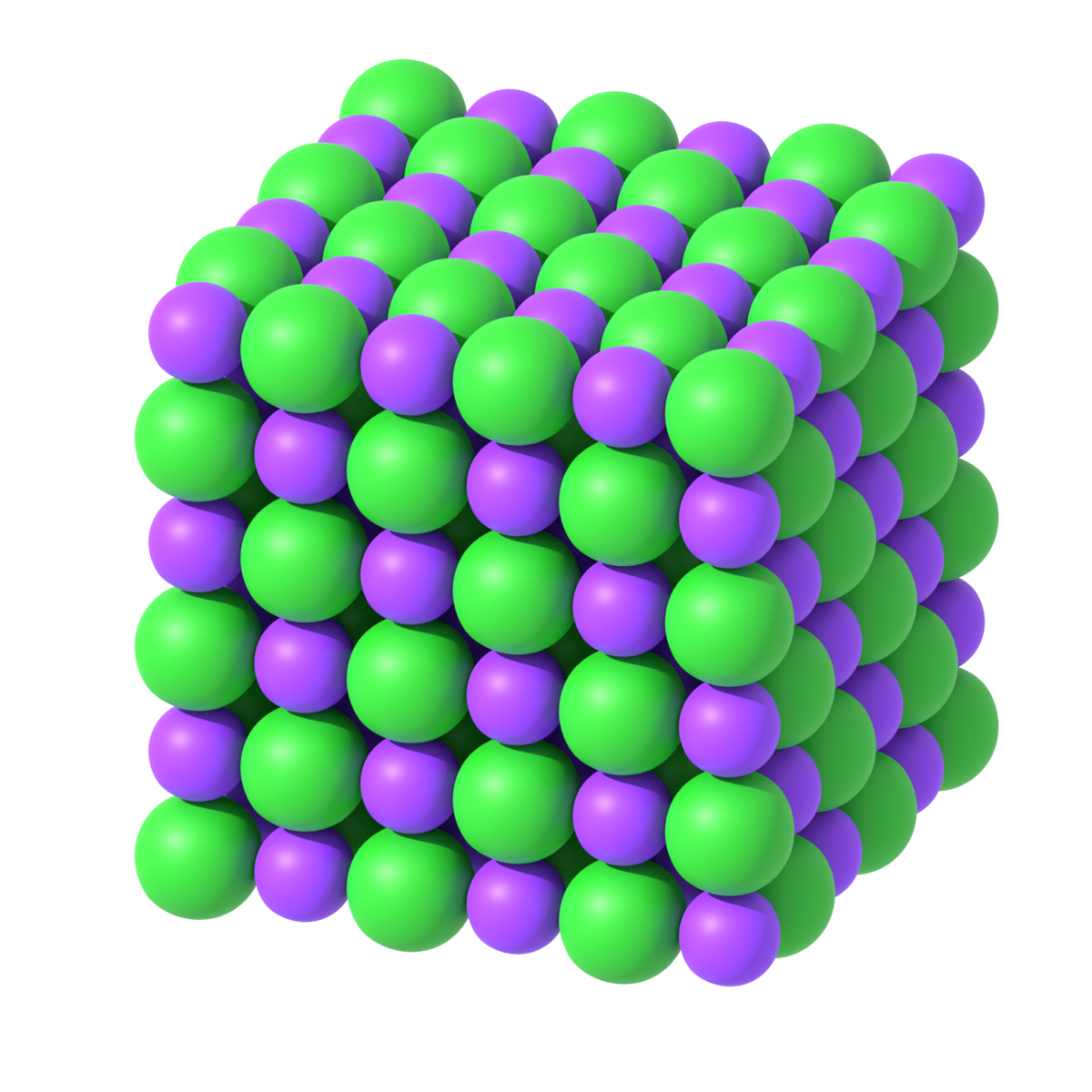
Ionebindinger er sterke bindinger på grunn av de sterke kreftene mellom en positiv ladning (kation) og en negativ ladning (anion). Dette påvirker egenskapene til salter i stor grad. For eksempel har salter høyt smeltepunkt, fordi de sterke ionebindingene delvis må brytes ned i smelteprosessen.
En forbindelse som er et salt smelter til en smelte som leder elektrisk strøm. Vanlig havsalt (NaCl) er et salt, mens silisiumdioksid (SiO2) og aluminiumklorid (AlCl3) ikke er det.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.