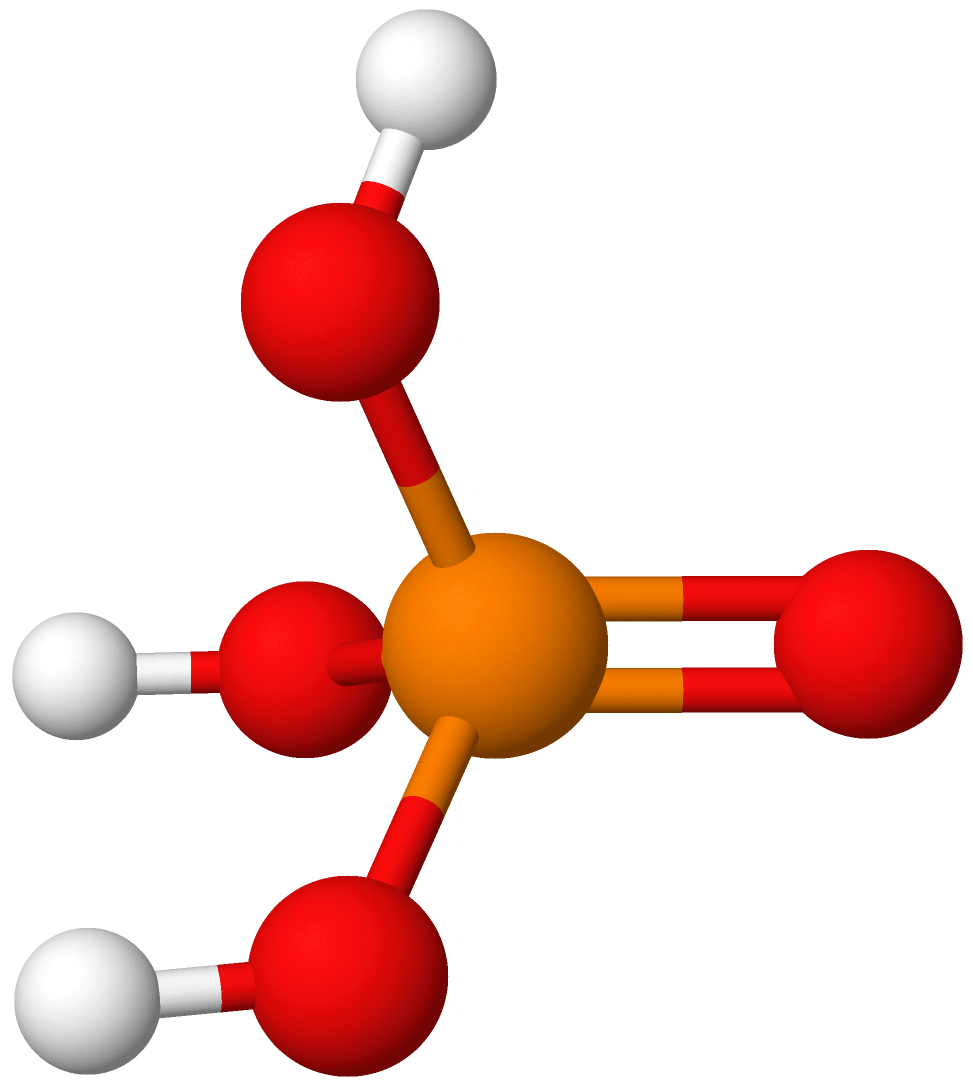
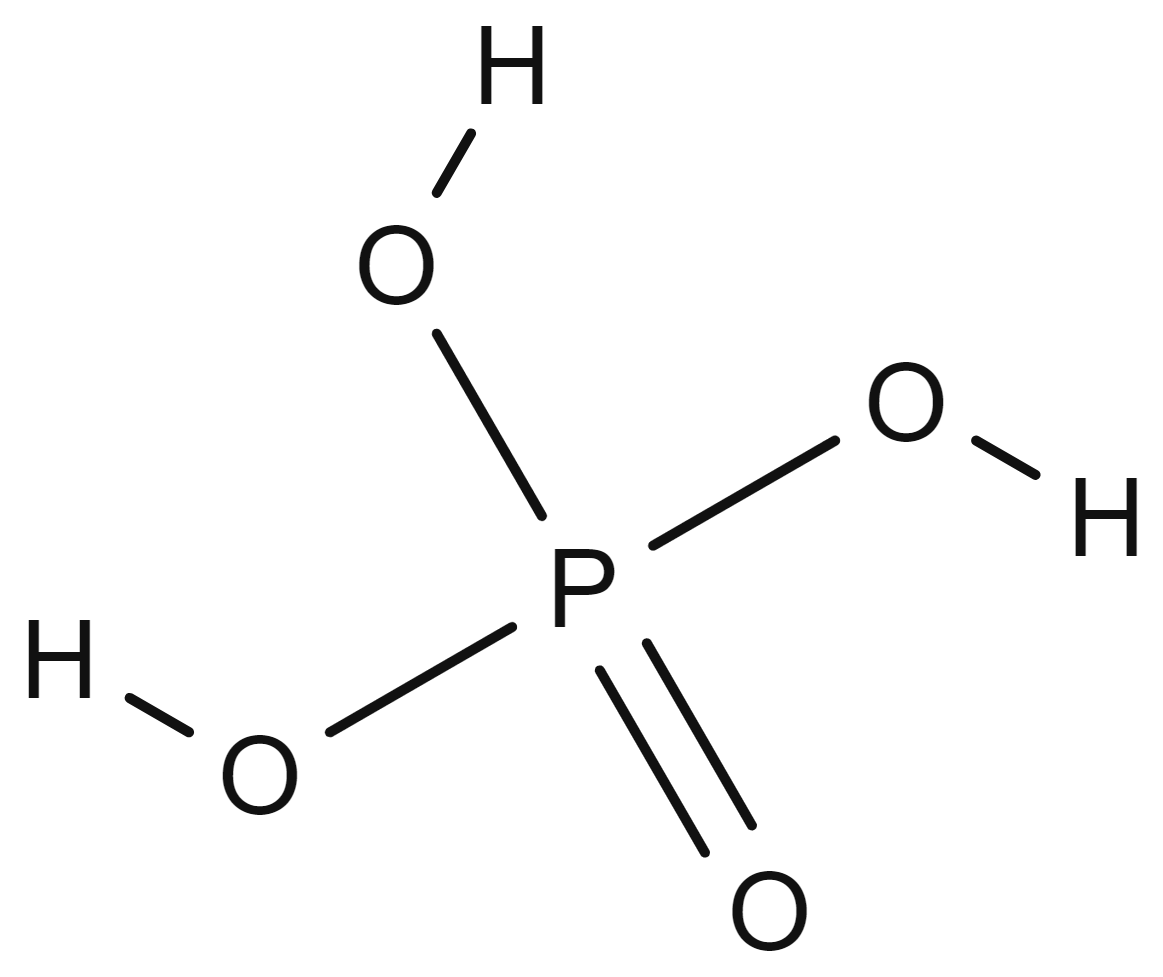
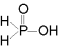
Fosfor(III)syre (HO)2HP=O er toprotisk, da det ene hydrogenatomet er bundet direkte til fosfor, og derfor ikke lar seg bytte ut med metall. Fosforsyrling er et krystallinsk, fargeløst, meget hygroskopisk, fast stoff med smeltepunkt 74 °C.
I smeltet tilstand er fosforsyrling en viskøs væske som disproporsjonerer under utvikling av brennbare, giftige damper av fosfin og går over i fosforsyre:
4(HO)2HPO2 (l)→ 3(HO)3PO (l) + PH3 (g)
Fosforsyrling danner to rekker av salter, primære og sekundære. Syren og dens salter er sterke reduksjonsmidler. Pyro- og metaformer av syren finnes, men er ikke viktige.
Estere av fosforsyrling anvendes blant annet til syntese av insekticider, legemidler, klebestoffer, mykningsmidler, ekstraksjonsstoffer og brannsikre tilsetninger til plast og tre. Organisk substituerte derivater av fosforsyrlig, for eksempel etylfosforsyrling, H5C2PO(OH)2, brukes blant annet til bløtgjøring av hardt vann og til fremstilling av legemidler.





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.