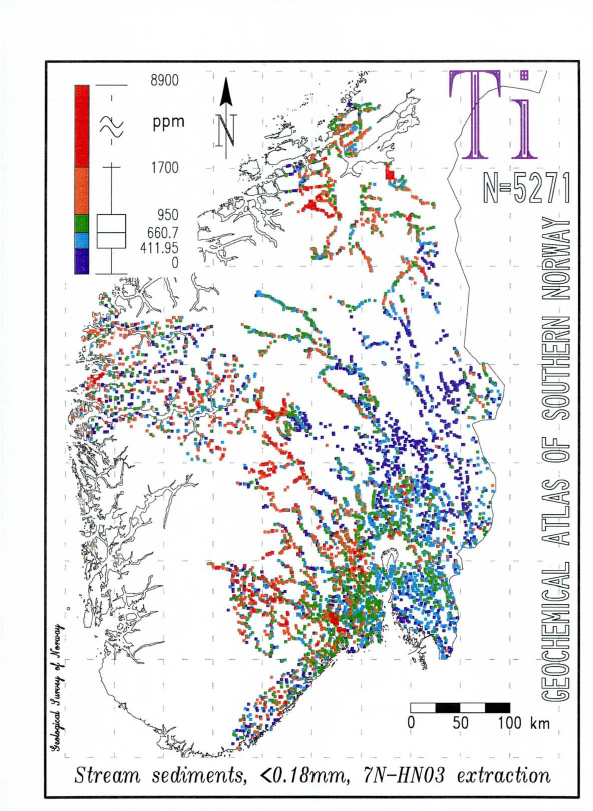
Råstoffer for fremstilling av titan er først og fremst ilmenitt og rutil. I tillegg spiller titanslagg fra titanholdig jernmalm en viss rolle. Ilmenittholdig malm blir knust, pulverisert og opparbeidet til konsentrat med 40–70 prosent titan(IV)oksid ved flotasjon og ved magnetiske og elektrostatiske metoder. Opparbeidelsen av rutilsand gir konsentrater med 90–98 prosent titan(IV)oksid. Ilmenittkonsentratene brukes fortrinnsvis til fremstilling av rent titan(IV)oksid, mens rutilkonsentratene blir brukt til fremstilling av titan(IV)klorid for videre bearbeidelse til titanmetall og oksid.
Titanklorid fremstilles ved å reagere titan(IV)oksid med karbon og klor, som denne reaksjonsligningen viser:
TiO2 (s) + 2C (s) + Cl2 (g) → TiCl4 (g) + 2CO (g)
Den langt største produsenten av rutilkonsentrat er Australia, som står for om lag 90 prosent av verdensproduksjonen. Verdensproduksjonen av ilmenittkonsentrat er nesten ti ganger større enn for rutil, og de største produsentlandene er Australia, Norge, Canada, USA og Russland.
Titan danner svært stabile forbindelser med oksygen, nitrogen og karbon, og titanmetall kan derfor ikke fremstilles ved å redusere titan(IV)oksid med for eksempel karbon eller hydrogen.






Kommentarer (1)
skrev iman kaiharova
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.