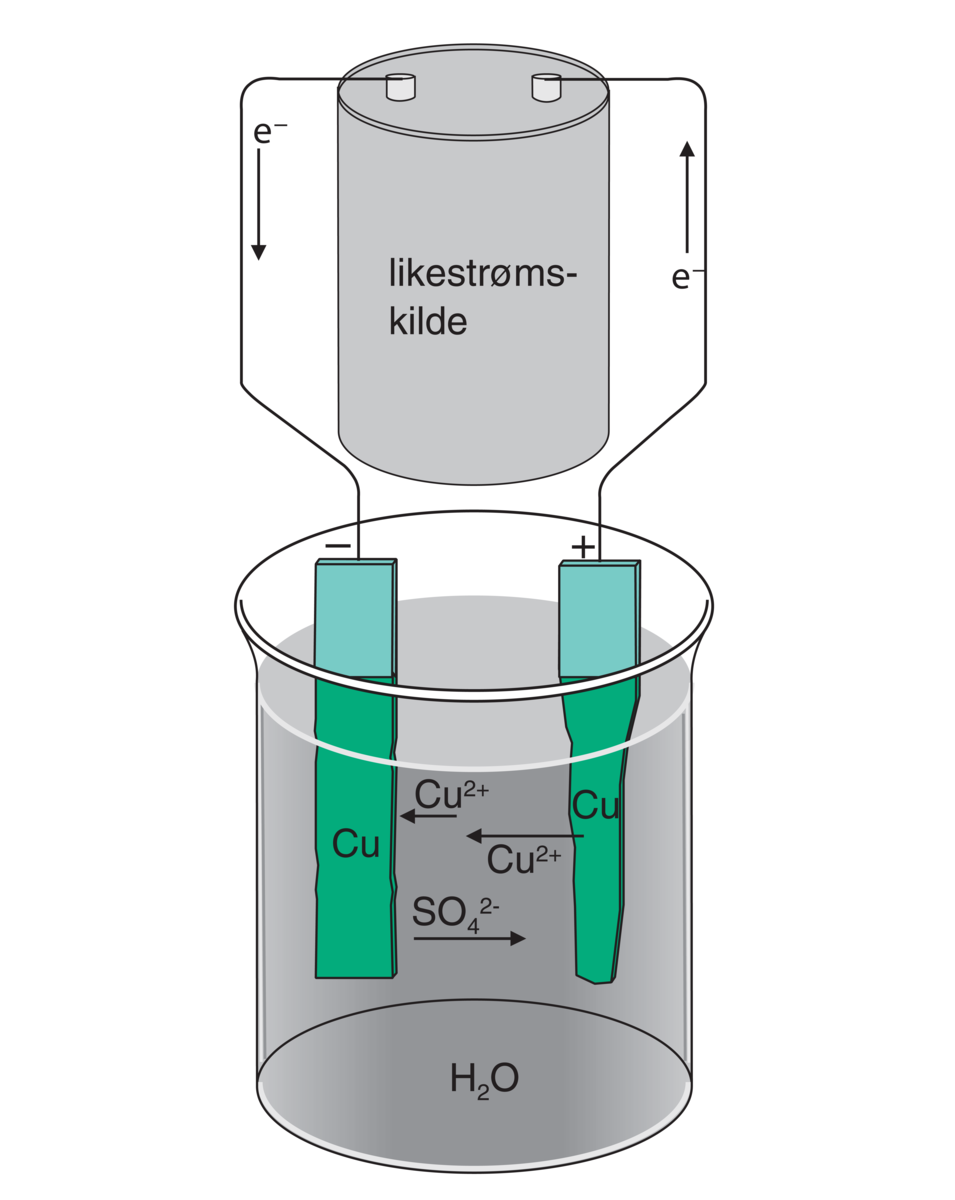
Anode er den elektroden i en elektrokjemisk celle der det skjer en oksidasjonsreaksjon. Anoden blir den positive elektroden i en elektrolysecelle, mens den blir den negative elektroden i en spontan elektrokjemisk celle i et batteri eller ved korrosjon. Den motsatte elektroden kalles katode.
For oppladbare batterier vil anoden være negativ under utladning og positiv under lading. Derfor er det mest hensiktsmessig å bruke positiv og negativ elektrode istedenfor anode og katode ved omtale av oppladbare batterier (sekundærbatterier).
Betegnelsen anode ble først brukt av den britiske kjemikeren og fysikeren Michael Faraday (1791–1867).
Betegnelsen anode brukes også om et gassutladningsrør eller et vakuum-elektronrør.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.