Krystallstruktur er hvordan atomene er ordnet i et krystallinsk fast stoff.
En krystall kan beskrives som en tredimensjonal stabel av enhetsceller. Når krystallstrukturen er bestemt betyr det at vi vet hvilke atomer som er i enhetscellen, og hvordan de er plassert der. Dette kan bestemmes med røntgenkrystallografi for tyngre atomer enn hydrogen. Posisjonen av hydrgenatomene kan bestemmes med nøytrondiffraksjon. Supplerende informasjon kan man finne ved å bruke forskjellige spektroskopiske metoder.
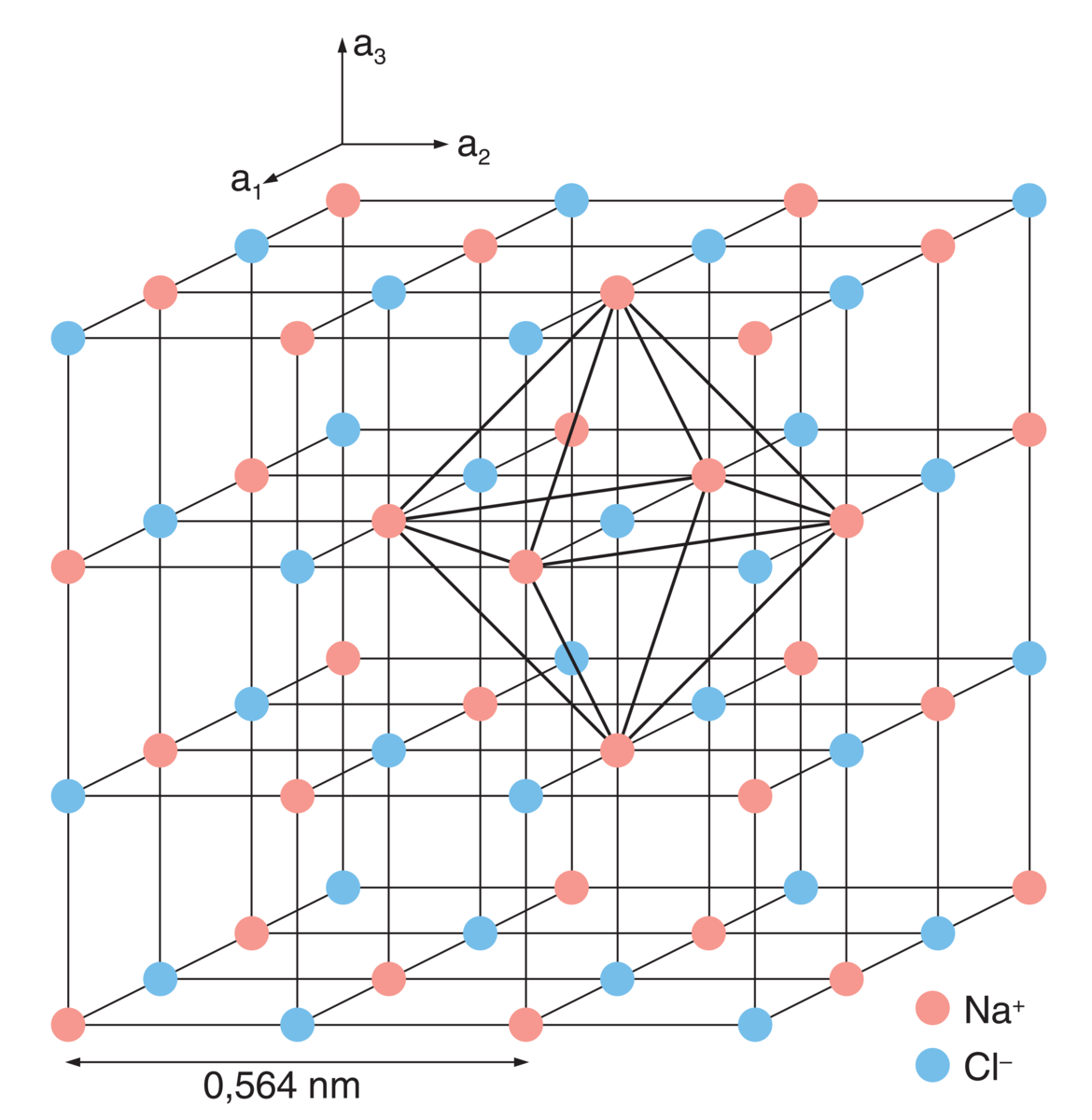
De første krystallstrukturer ble bestemt i 1912. Det var strukturen av enkle uorganiske salter og metaller. Siden har stadig mer kompliserte strukturer blitt bestemt av betydning både i mineralogi, faststoff-fysikk, organisk kjemi, biokjemi og biologi, se IUCr.
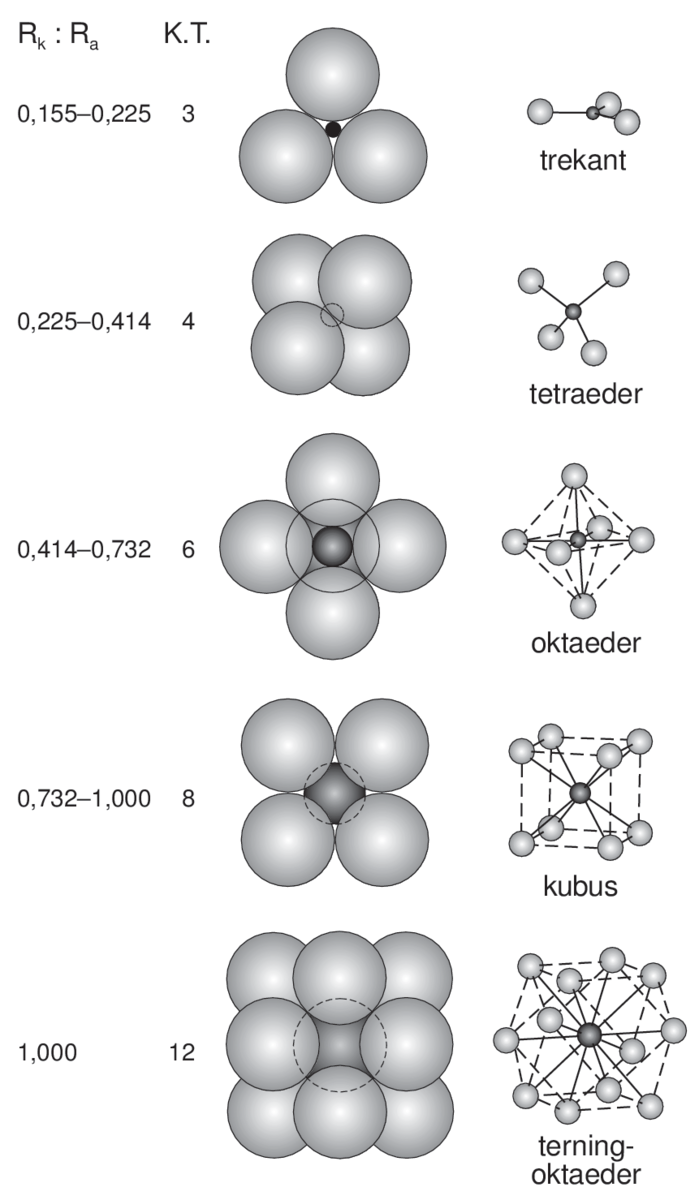
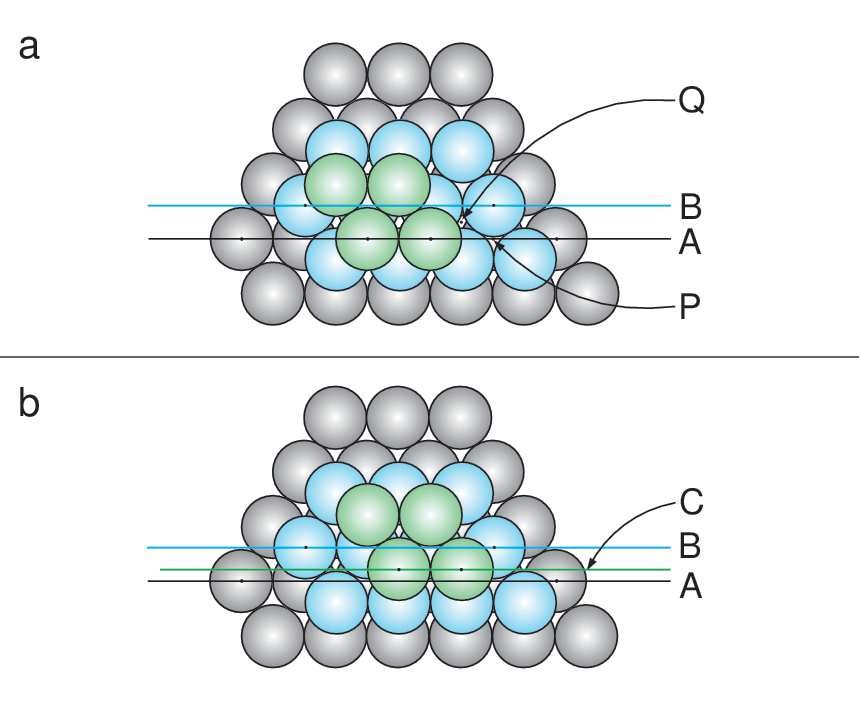
Strukturen av mange metaller kan beskrives som former av tetteste kulepakning.
I mange sammenhenger bruker man engelske forkortelser når det er snakk om ulike krystallstrukturer:
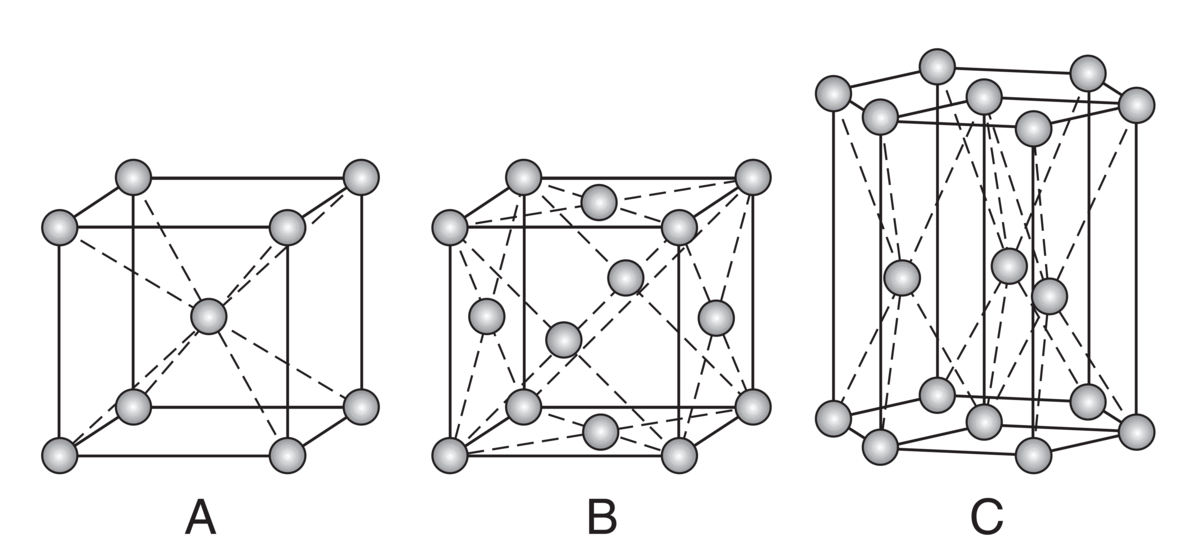
- BCC – Body-centered cubic, romsentrert kubisk
- FCC – Face-centered cubic, flatesentrert kubisk
- HCP – Hexagonal close-packed, heksagonal tettpakket




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.