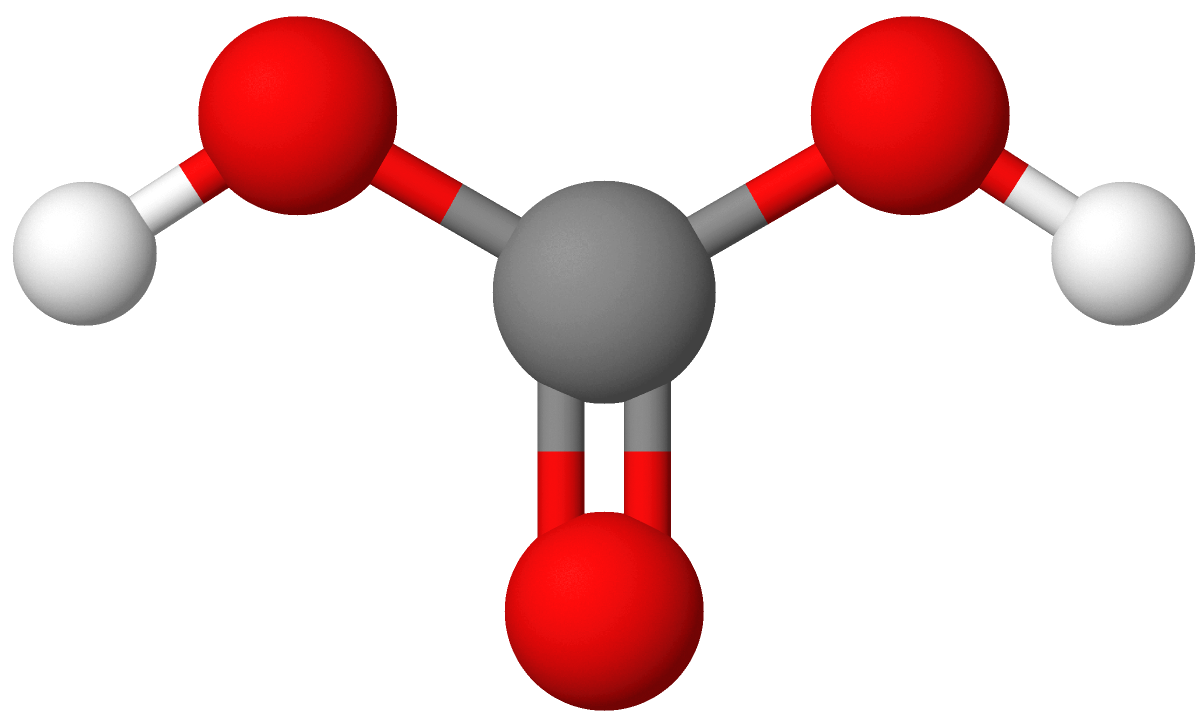
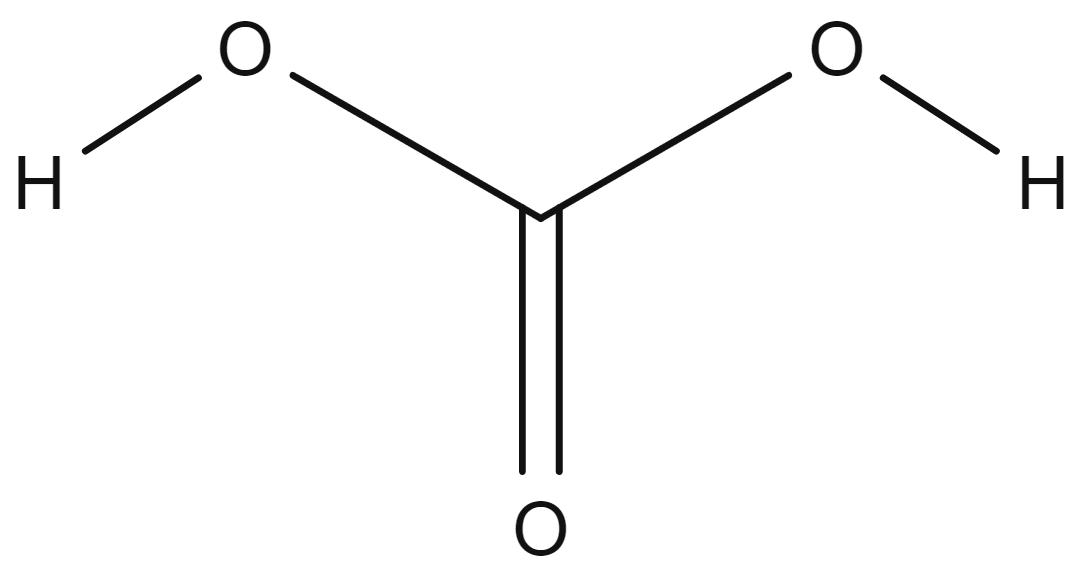
Karbonsyre er en svak syre som tidligere ble kalt kullsyre. Molekylformelen for karbonsyre er H2CO3, og strukturformelen er (HO)2C=O.
Faktaboks
- Også kjent som
-
kullsyre, kolsyre, kôlsyre, H2CO3(aq)
Når karbondioksid løses i vann, blir løsningen svakt sur. Det skyldes at det dannes litt karbonsyre i vannet (bare ca, 0,2 prosent).




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.