I termodynamikken snakker man gjerne om et eller flere system. Et system er kort fortalt en stoffmengde målt i kilogram eller mol. Systemet kan være hele universet, Jorden, en maskin, et menneske eller et glass med melk. Systemet kan delta i kjemiske eller fysiske prosesser. Man deler også gjerne inn i åpne systemer, som deler energi og masse med omgivelsene, eller lukkede systemer som bare kan dele energi med omgivelsene. Jorden er et åpent system, siden den kan både motta og gi både masse og energi til verdensrommet. En termosflaske er et eksempel på et lukket system.
Et system er karakterisert av ekstensive tilstandsvariabler, som for eksempel volum og stoffmengde, og intensive tilstandsvariabler som trykk og temperatur. Et eksempel på et system karakterisert av disse variablene er en ideal gass med stoffmengde n, volum V, trykk p og temperatur T. For denne gassen er tilstandsligningen pV=nRT, der R er gasskonstanten.
Man sier også at et system har en indre energi U. I en ideal gass som består av N partikler som ikke vekselvirker, vil den indre energien kun være avhengig av temperaturen som U=3/2(NkBT), der kB er Boltzmanns konstant. Dersom systemet består av molekyler som kan vekselvirke med hverandre, vil uttrykket for den indre energien være mer komplisert. For mange biologiske og komplekse systemer, som for eksempel mennesket, kan man ikke forvente å kunne beskrive den indre energien som en funksjon av tilstandsvariabler i det hele tatt.
Det er mulig å utføre et arbeid W på et system. For eksempel vil omgivelsene utføre et arbeid W= pΔV på et system som holder konstant trykk p, samtidig som det komprimeres med volumet ΔV. Systemet utfører på samme tid et arbeid W’=-W=- pΔV på omgivelsene. I henhold til IUPACs konvensjon er W>0 når arbeid utføres på systemet, men mange fysikere og ingeniører benytter ikke denne konvensjonen og regner heller arbeidet som positivt dersom W’>0 og utføres av systemet på omgivelsene.
Et system kan tilføres varme Q fra omgivelsene. I de fleste tegnkonvensjoner er Q>0 når varme tilføres systemet. For eksempel vil man ved å koke opp vann i et kar tilføre varme til vannet fra kokeplaten. Det er også mulig for systemet å tilføre varme til omgivelsene slik at Q<0. Dette skjer når man skrur av kokeplaten slik at vannet, som har høyere temperatur enn omgivelsene, kan kjøle seg ned og avgi varme.
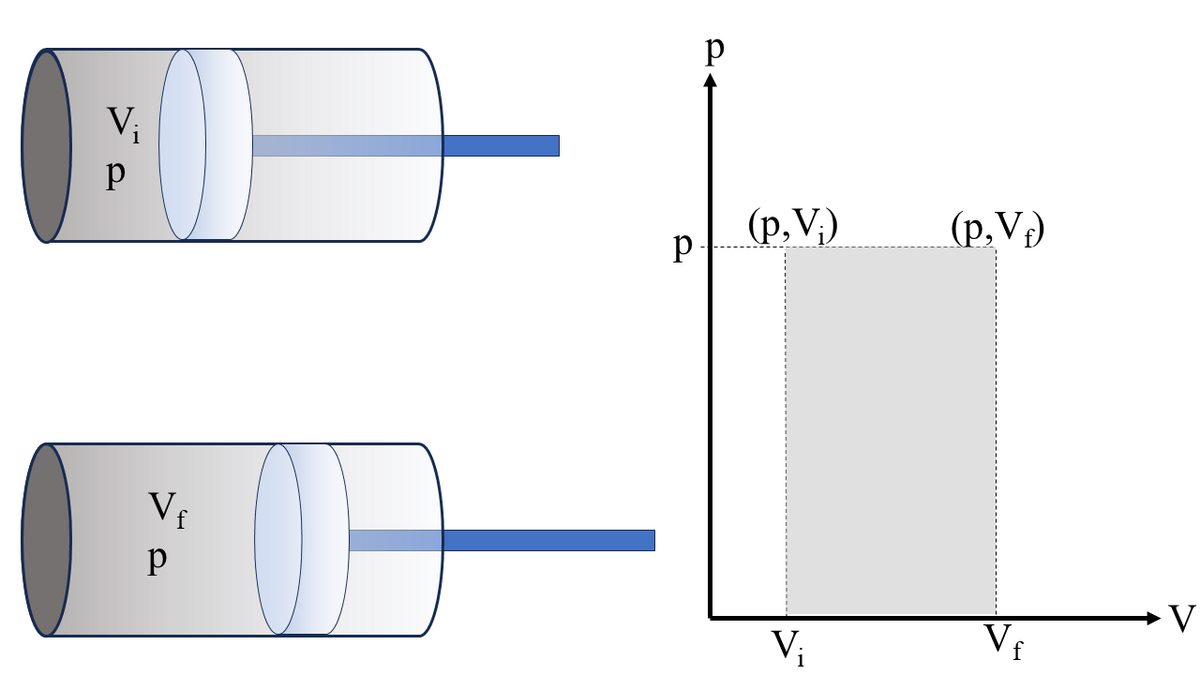
Et system kan utsettes for en prosess, det vil si en bevegelse eller syklus der tilstandsvariablene endres underveis. For eksempel kan vi tenke oss at en ideal gass lukket inne i en sylinder opprinnelig har et volum Vi og trykk p som holdes på plass av et stempel som kan skyves friksjonsfritt. Dersom sylinderen tilføres varme, vil gassen ekspandere slik at den får nytt volum Vf. Dersom trykket samtidig holdes konstant inne i sylinderen, sier vi at gassen er utsatt for en isobarisk prosess. Gassen utfører et arbeid W’=pΔV>0 på stempelet, der ΔV=Vf-Vi > 0. Det finnes også andre prosesser et system kan gjennomgå. Dersom man for eksempel holder volumet til en gass konstant, kalles det en isokorisk prosess. I et annet tenkt tilfelle tilføres ikke systemet varme, og man sier at det gjennomgår en adiabatisk prosess. En slik adiabatisk prosess er mulig å få til ved å isolere systemet slik at ingen varme slipper ut eller inn, som i en termosflaske. Det er også mulig å lage en adiabatisk prosess ved å gjennomføre prosessen så hurtig at det ikke er tid til å overføre varme. Når et system gjennomgår en faseforandring, for eksempel fra faststoff til væske, holder det konstant temperatur og gjennomgår derfor det som kalles en isotermisk prosess. Et eksempel er når is smelter til vann, som foregår ved T=273,15 K.
Man skiller mellom reversible og irreversible prosesser. En reversibel prosess er en prosess der systemet kan returneres til sin opprinnelige tilstand uten at noe har forandret seg. For eksempel er en adiabatisk ekspansjon av gass i en sylinder en reversibel prosess dersom stempelet kan bevege seg frem og tilbake uten friksjon. Imidlertid kjenner man ikke til slike friksjonsfrie systemer, og generelt er alle kjente naturlige prosesser irreversible. Det betyr at man alltid taper noe energi til omgivelsene i løpet av en prosess.
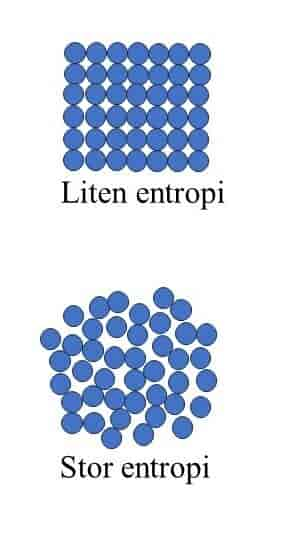
Entropi er en tilstandsfunksjon som ofte benyttes i termodynamikk. Dersom et system som har temperatur T (i Kelvin), tilføres en liten mengde varme ΔQ, er forandringen i entropi gitt som ΔS=ΔQ/T. Det er vanlig å regne ut entropien ved faseforandringer, siden disse foregår ved konstant temperatur. For eksempel vet man at 1 kg is smelter ved 273,15 K og krever 3.3∙105 J, som betyr at entropiforandringen kan beregnes til å være ΔS=3,3∙105 J /273,15 K =1,2∙103 J/K. Entropien til isen øker, siden den tilføres varme. På tilsvarende måte avtar entropien til omgivelsene, siden disse mister varme. På mikroskopisk nivå forstås entropi i statistisk termodynamikk som et mål for uorden. Når isen smelter, går vannmolekylene fra å være i et fast gitter til å virrevandre i væsken og dermed ha flere tilgjengelige energitilstander og mer uorden. Omgivelsene vil samtidig kjøles ned slik at molekylene i de omliggende stoffene får mindre uorden og dermed også mindre entropi. Dersom et stoff har Nw antall mikrotilstander med samme energi, er det etter Ludwig Boltzmann mulig å skrive entropien som S=kBln(Nw), der kB er Boltzmanns konstant og ln er den naturlige logaritme. For eksempel vil alle atomene i en perfekt krystall ved absolutt null (T=0 K) være i samme energitilstand, slik at Nw=1 og S=kBln(1)=0 siden ln(1)=0. Etter hvert som man varmer opp krystallen, vil atomene begynne å vibrere og forskyve seg fra hverandre og lage defekter i den ellers perfekte krystallstrukturen. Dermed øker antall mikrotilstander, slik at S også øker. Generelt observerer man at entropien er minst for et fast stoff, en del større for en væske og størst for en gass, siden denne har mest tilgjengelige mikrotilstander molekylene kan befinne seg i.








Kommentarer (2)
skrev Gunn Myhr Fossen
Hei!
Jeg lurer på hvordan en kan forklare utviklingslæren/darvins lære men den andre termodynamiske loven som bakteppe? I følge denne loven går det bare fra "orden til kaos"/fra liten til stor entropi.
Om vår verden er et lukket system, overlatt til seg selv og tilfeldigheter hvordan kan det da ha utviklet seg fra ingenting til det den er i dag ?
Jeg lurer på hvordan det er mulig, og hvordan det forklares i deres fagmiljø?
Med vennlig hilsen Gunn M. Fossen
svarte Marit M. Simonsen
Hei! Takk for spørsmålet. Jorden ikke er noe lukket system, men mottar enorme mengder energi fra Sola som brukes til å bygge opp og gi energi til alt som lever. Vennlig hilsen Marit, biologiredaktør
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.