indre energi
Indre energi i en ideal gass
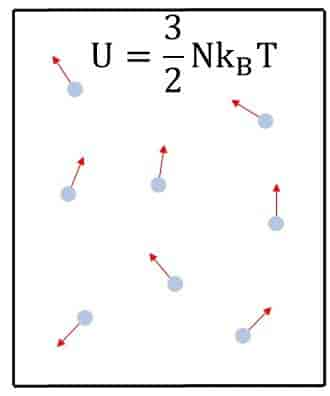
I en ideal gass som består av N partikler som ikke vekselvirker, vil den indre energien kun være avhengig av temperaturen T som U=3/2(NkBT), der kB er Boltzmanns konstant. Den indre energien påvirkes ikke av hvor fort hele beholderen med den ideelle gassen beveger seg eller hva slags potensiell energi hele beholderen har i for eksempel tyngdefeltet, da dette ikke påvirker partiklenes relative bevegelser inne i selve beholderen.
Indre energi i komplekse systemer
En ideal gass er et av de enkleste systemene vi kan tenke oss, da all energien er relatert til bevegelsen til partiklene. I et mer komplisert system, som for eksempel en væske eller faststoff, vil partiklene utøve krefter på hverandre. Da vil den indre energien også avhenge av disse vekselvirkningene.
Dersom systemet består av molekyler som kan vekselvirke med hverandre, vil uttrykket for den indre energien være mer komplisert. For mange biologiske og komplekse systemer, som for eksempel mennesket, kan man ikke forvente å kunne beskrive den indre energien som en funksjon av tilstandsvariabler i det hele tatt.
Forandringer i indre energi
I en ideell gass kan man relatere den indre energien direkte til temperaturen. I reelle systemer har man i hovedsak ingen slik direkte sammenheng, og den absolutte indre energien kan ikke måles direkte. Imidlertid kan man finne forandringer i den indre energien ved å måle arbeid utført på og varme tilført systemet. Termodynamikkens første lov uttrykker nemlig at dersom det gjøres et arbeid W på systemet samtidig som det tilføres varme Q, så vil forandringen i systemets indre energi være gitt av ΔU=Q+W.
Som et eksempel kan man finne forandringen i indre energi dersom en motorisert visp rører om på 0,1 kg vann i en varmeisolert termosflaske slik at temperaturen i vannet stiger med 1 ◦C. Her er systemet 0,1 kg vann som er varmeisolert fra omgivelsene. Det betyr at Q=0 siden ingen varme slipper inn eller ut. Siden vann har spesifikk varmekapasitet 4180 J/kg∙◦C, så vil vannet tilføres en indre energi ΔU = (0,1 kg) ∙ (4180 J/kg∙◦C) ∙ 1 ◦C = 418 J. Siden W = ΔU, så er 418 J også det arbeidet som vispen gjør på vannet for å øke temperaturen.
Les mer i Store norske leksikon




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.