Maxwell-Boltzmanns fordelingslov beskriver fordelingen av hastighetene til molekylene i en gass.
Faktaboks
- Uttale
- mˈækswəl –
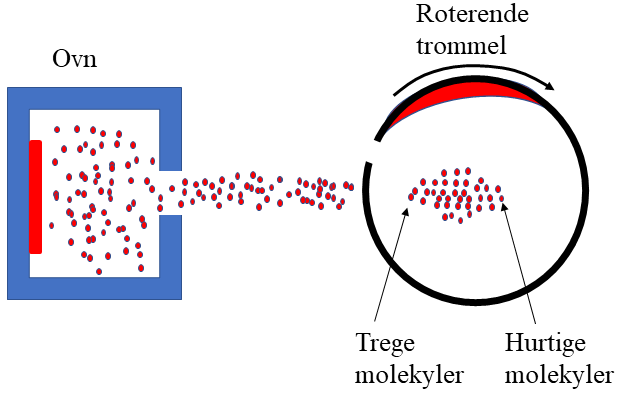
I en gass vil noen av molekylene ha liten hastighet, mens andre har stor hastighet, og dette avhenger av temperaturen og massen til molekylene. Fordelingen av hastigheter som molekylene i gassen har bestemmes av en fordelingsfunksjon f(v), slik at et lite antall ΔN av molekyler har hastigheter mellom v og v+Δv der ΔN=f(v)Δv. Når gassen er i termisk likevekt og består av molekyler som virrevandrer rundt omkring, viste James Clerk Maxwell og senere Ludwig Boltzmann på 1800-tallet at man kan skrive
\[f(v) =4\pi Nv^2 (m/2 \pi kT)^{3/2} exp(-mv^2/2kT)\]
Her er N antall molekyler i gassen, k er Boltzmanns konstant, T er temperaturen og m er molekylenes masse. Denne ligningen kalles Maxwell-Boltzmanns fordelingslov, og den kan utledes ved at man antar molekylene som oppfører seg som klassiske partikler. Dersom dette ikke er tilfellet, må man benytte kvantestatistikk for å komme frem til den tilsvarende fordelingsloven.
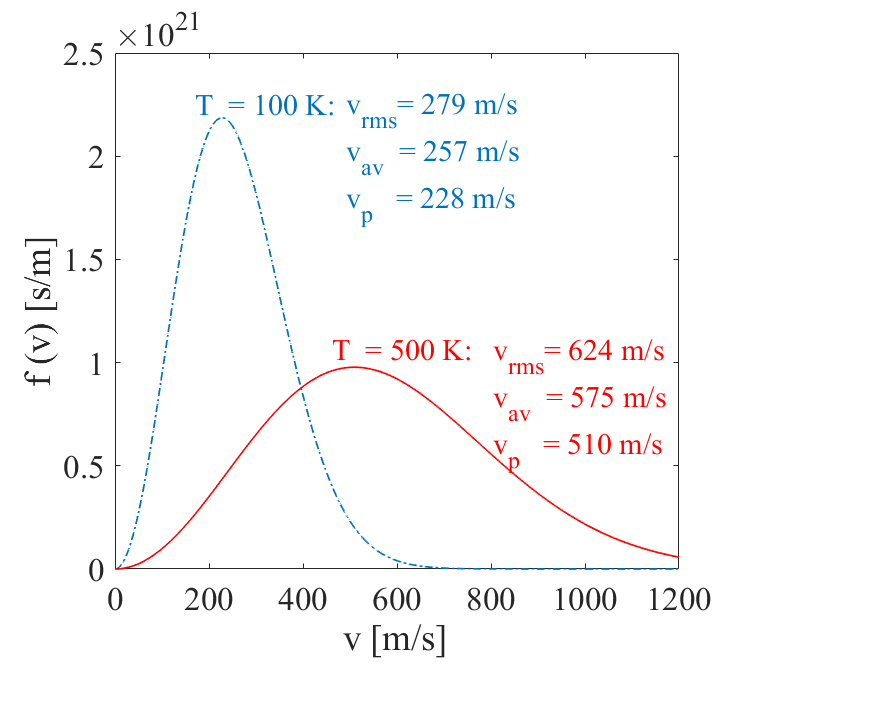
Maxwell-Boltzmanns fordelingslov kan brukes til å finne rms-hastighet (vrms) og gjennomsnittshastighet (vav) til molekylene i en gass gitt ved
\[v_{rms} =\sqrt{3kT/m} \] \[v_{av} =\sqrt{8kT/\pi m} \]
For oksygengass vil for eksempel vrms=624 m/s og vav=575 m/s ved T=500 K.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.