Varmekapasiteten til en gass avhenger av hvorvidt man tilfører varme under konstant volum eller konstant trykk. Molar varmekapasitet ved konstant volum skrives gjerne CV, og ved konstant trykk CP.
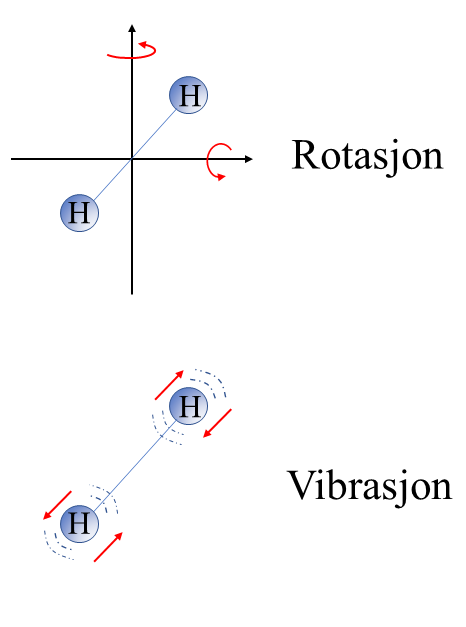
Dersom man tilfører varme til en gass i en beholder med konstant volum, vil den kinetiske energien til gassmolekylene øke uten at volumet øker. For hver frihetsgrad f, tilføres gassmolekylene den kinetiske energien 1/2kBT, der kB=1,38∙10-23 J/K er Boltzmanns konstant og T er temperaturen. For eksempel vil en monoatomisk gass som neon ha f=3 frihetsgrader siden atomene bare kan bevege seg rettlinjet i tre uavhengige retninger, slik at det tilføres en energi (3/2)kBT per atom. Et toatomig molekyl som hydrogen (H2) vil kunne ha f=7 frihetsgrader, da det i tillegg til å bevege seg rettlinjet i tre uavhengige retninger også kan rotere og vibrere. Molekylet kan rotere om to ulike uavhengige akser, og dette gir to ekstra frihetsgrader. I tillegg kan molekylet vibrere om en forbindelseslinje mellom hydrogengenatomene, som også gir to ekstra frihetsgrader. Til sammen blir det f=7 frihetsgrader, slik at maksimum kinetisk energi som kan tilføres per molekyl er (7/2)kBT. For gasser med flere og mer komplekse molekyler kan man ha enda flere frihetsgrader.
Dersom man tenker seg at gassen består av N molekyler, og all varmen som tilføres gassen omgjøres til kinetisk energi ΔQ som gir en temperaturøkning ΔT, så vil ΔQ=N(f/2)kBΔT. Her er NkB=nR, der n er antall mol og R=8,314 J/(K·mol)er gasskonstanten, slik at ΔQ=(f/2)nRΔT. Dette betyr at den molare varmekapasiteten ved konstant volum for en gass som har molekyler med f frihetsgrader er
\[ C_{V} = \frac{ \Delta Q}{n\Delta T} = R\frac{f}{2} \]
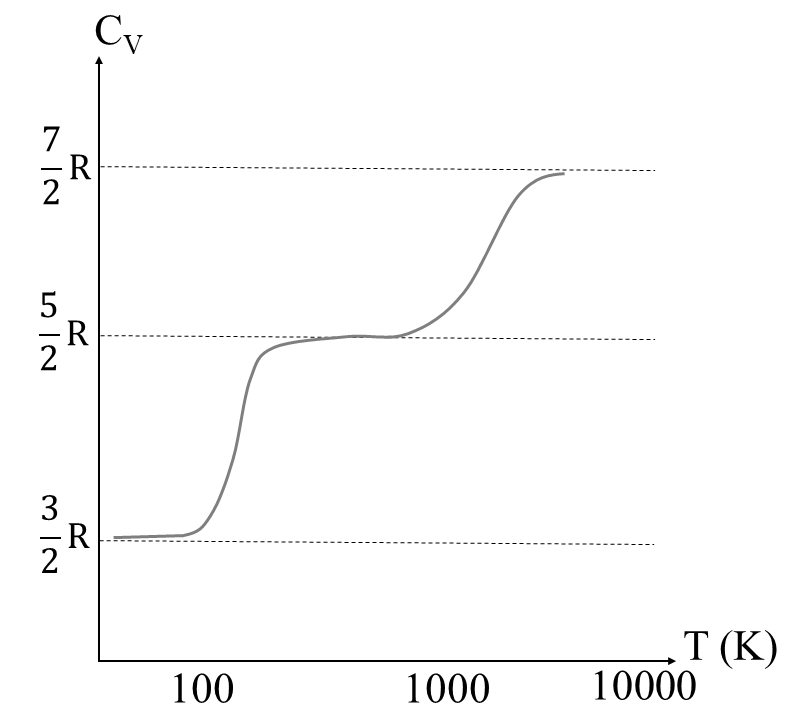
Monoatomiske gasser som neon har molar varmekapasitet ved konstant volum gitt ved CV=(3/2)R=12,5 J/(K·mol), i overensstemmelse med målinger. For hydrogen forventer man at CV=(7/2)R=29,1 J/(K·mol). Nå er det imidlertid slik at det ikke er mulig for hydrogenmolekylene å rotere eller vibrere ved lave temperaturer godt under T=100 K. Ved slike lave temperaturer måler man CV≈12,5 J/(K·mol), som tyder på at molekylet bare har tre frihetsgrader tilsvarende rettlinjet bevegelse i tre uavhengige retninger. Ved temperaturer over 100 K starter hydrogenmolekylene å rotere, og gassen får da en molar varmekapasitet ved konstant volum omtrent lik (5/2)R. Ved svært høye temperaturer over 1000 K begynner den molare varmekapasiteten ved konstant volum å nærme seg (7/2)R, som tyder på at molekylene nå også vibrerer.
Dersom man ønsker å finne varmekapasiteten ved konstant trykk, må man ta hensyn til at varmen går med til å øke den kinetiske energien med (f/2)nRΔT samt øke volumet til beholderen som inneholder gassen med ΔV. Siden en slik volumøkning ved konstant trykk P krever et arbeid PΔV, vil varmen være ΔQ=(f/2)nRΔT+ PΔV. Dette betyr at den molare varmekapasiteten ved konstant trykk er
\[ C_{P}= \frac{ \Delta Q}{n\Delta T} = R\frac{f}{2} +\frac{P}{n} \frac{\Delta V}{\Delta T} \]
Fra tilstandsligningen til en ideal gass vet vi at PΔV=nRΔT, slik at ΔV/ΔT=nR/P og dermed
\[ C_{P}= C_{V} + R \]
Denne ligningen kalles ofte Mayers ligning etter Julius von Mayer som først brukte den i 1842. Mayers ligning betyr at den molare varmekapasiteten til en ideal gass ved konstant trykk alltid er en faktor R større enn den molare varmekapasiteten ved konstant volum. Grunnen er ganske enkelt at ved konstant trykk brukes noe av energien til å øke volumet, og da vil varmekapasiteten til stoffet også øke. Ligningen er gyldig for ideelle gasser, men kan også utvides til å gjelde alle slags gasser og faste stoff.
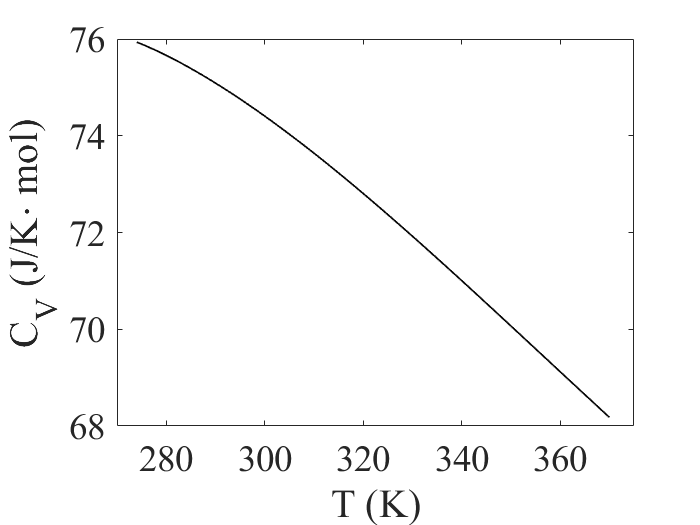
I tabellen under angis den molare varmekapasiteten til en del vanlige gasser ved konstant volum og 25 °C. Gasser som består av enkeltatomer har minst molar varmekapasitet. Toatomige gasser som hydrogen, nitrogen og oksygen har stort sett f=5 frihetsgrader ved romtemperatur og derfor en molar varmekapasitet nær CV=(5/2)R=20,8 J/(K·mol). Mer komplekse molekylære gasser vil kunne ha enda større antall frihetsgrader, og derfor også enda større molar varmekapasitet.





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.