Det er ikke foretatt spesielle geologiske undersøkelser for å finne thorium i Norge bortsett fra måling av gammastråling fra helikopter over Fensfeltet. Dette er et geologisk felt rikt på mange mineraler. Kunnskap om thoriumforekomster i Norge er i hovedsak basert på kartlegging av uranforekomster på 1960-tallet og i perioden 1975–1985 (NGU) fordi der er en viss korrelasjon mellom disse grunnstoffene. Ytterligere informasjon om thorium i norske bergarter er basert på undersøkelser av sjeldne jordartsmetaller (REE) som også ofte er delvis korrelert med thoriumforekomster.
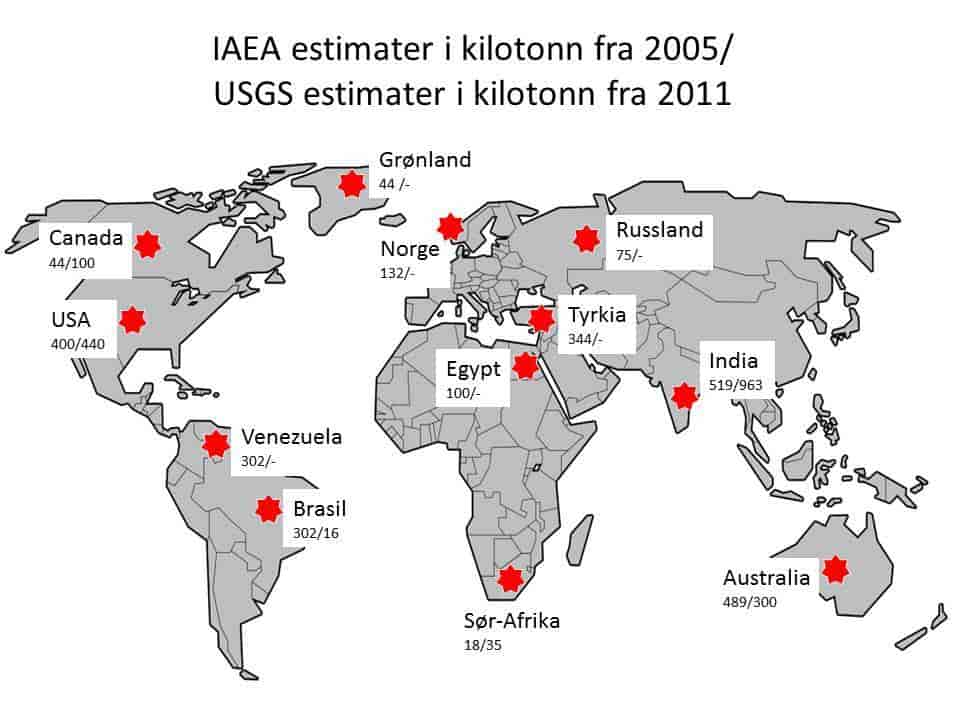
Thorium forekommer i omtrent alle mulige bergarter, men i svært variable mengder. I Oslofjordregionen finner vi thoriumanrikede granitter og granittpegmatitter i Østfold, områdene omkring Kragerø og Bamble, Nissedal og Fyresdal og Sigdal og Krødsherad. I Krekling-Hokksund-Modumområdet forekommer det relativt høye konsentrasjoner av thorium i alunskifer, men disse skiferne er mer kjent for sitt høye uraninnhold. Vest for Oslofjorden finnes thorium i syenitter og granitter av ulike typer. Lenger nord i landet er forekomster av thorium registrert i Høgtuva i Nordland og på Ytterøya i Nord-Trøndelag. Alle disse forekomstene, muligens med unntak av Seteråsen i Larvik, er trolig langt under grensene for drivverdighet.
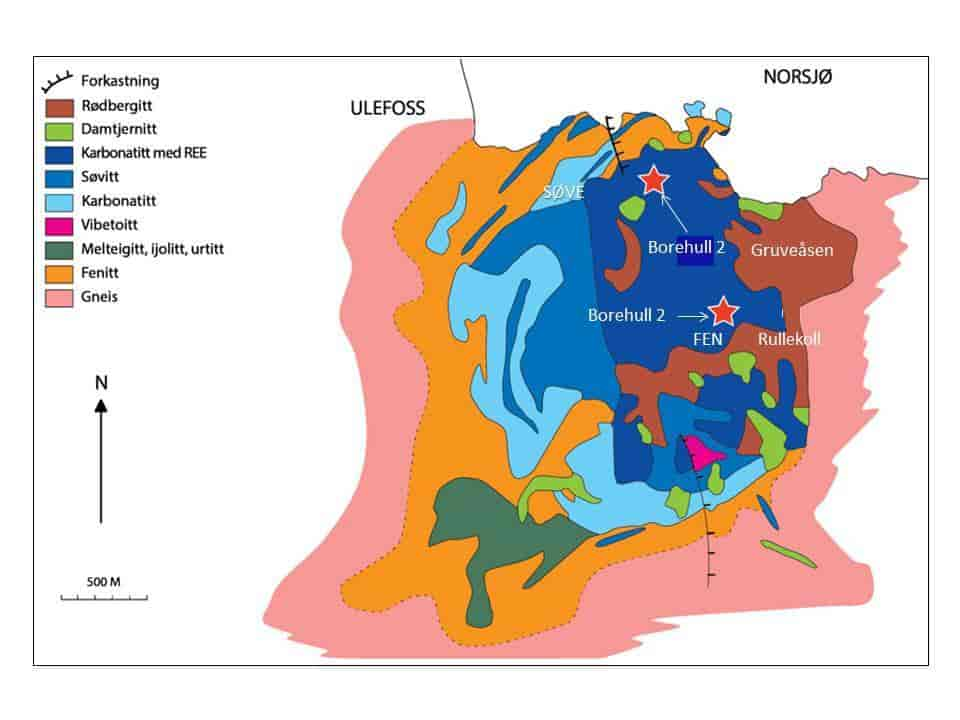
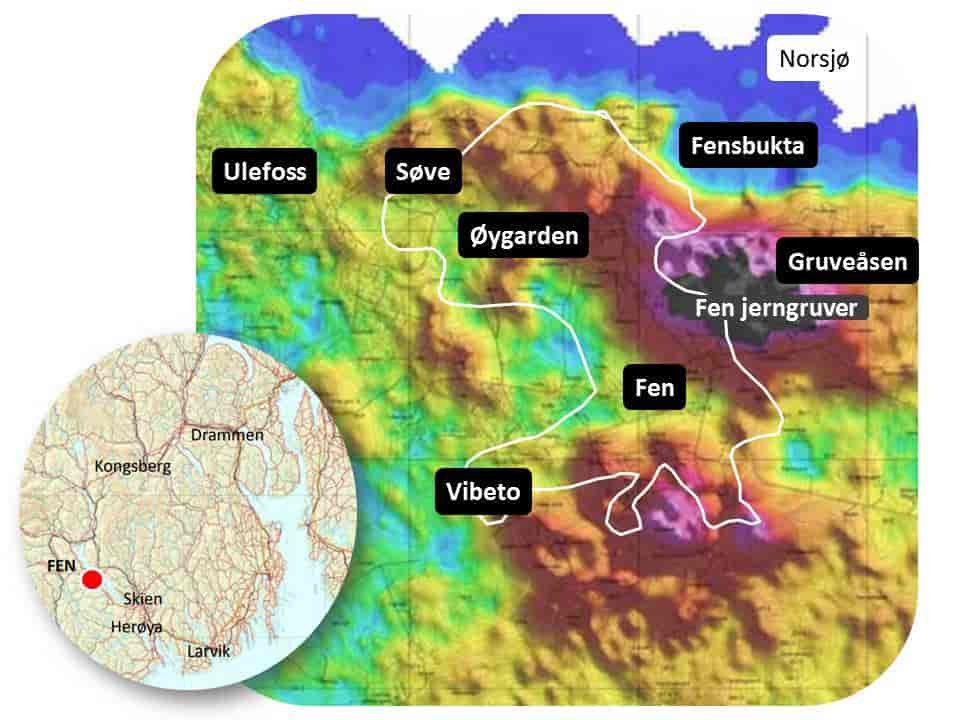
Landets klart største thoriumforekomst finnes i Fensfeltet.
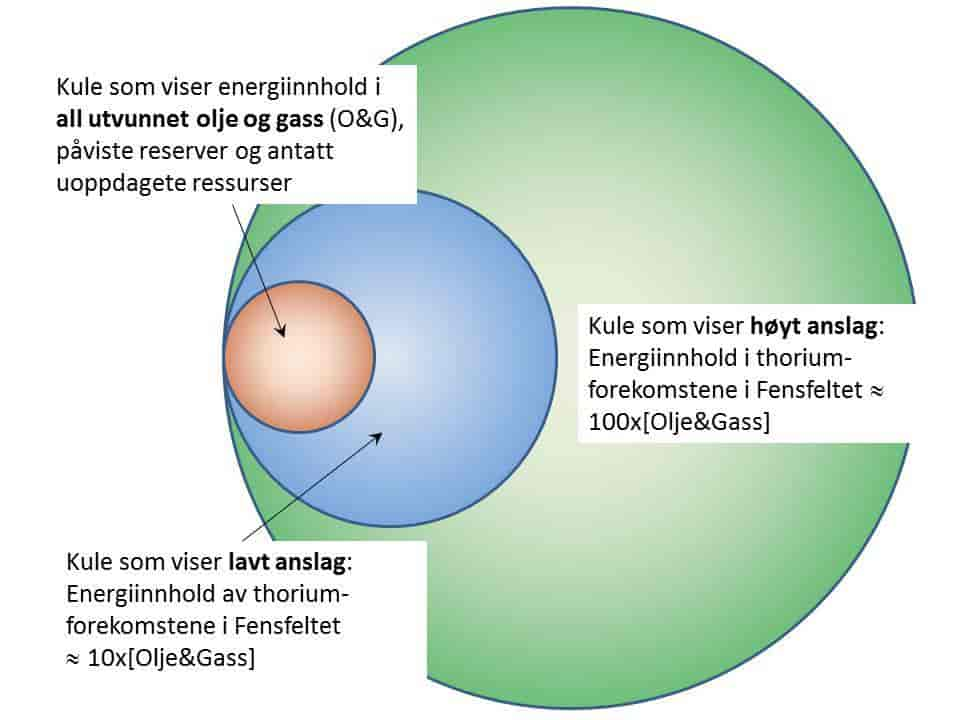
Der er målt thoriumkonsentrasjoner på opptil 4000 gram per tonn rødberg, men gjennomsnittskonsentrasjonen varierer mellom 872 g/tonn og 361 g/tonn i ulike områder. I ankerittkarbonatittene sentralt i området er gjennomsnittskonsentrasjonen 485 g/tonn. Det er stor usikkerhet i anslagene av hvor store thoriumressurser som finnes på Fensfeltet. Nye anslag tyder på at det er minst 56 500 tonn, men muligens finnes det 670 000 tonn eller enda mer. Forekomstene er hovedsakelig i form av små opphopninger som gjør det utfordrende, og for tiden økonomisk uinteressant, med gruvedrift, oppredning og framstilling.






Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.