damptrykk
Forklaring
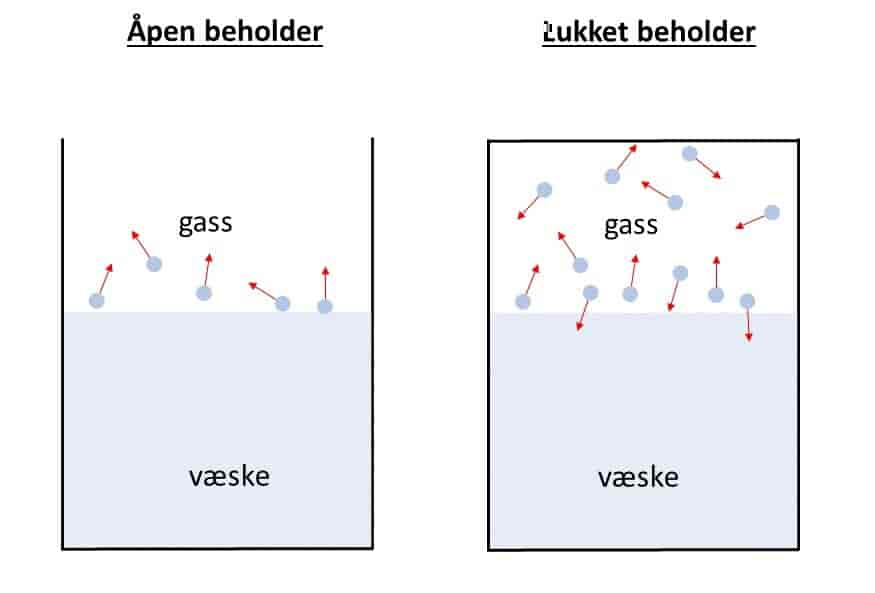
I en beholder som er delvis fylt med væske eller faststoff er molekylene i stadig bevegelse, og noen vil ha nok bevegelsesenergi til å unnslippe for å ende opp som relativt frie molekyler i gassen over væsken eller det faste stoffet. Denne prosessen kalles fordamping, og energien som kreves for å få dette til kalles fordampingsvarme. Noen av disse molekylene vil kollidere med overflatehinnen, og på nytt bli en del av væsken. Når i gjennomsnitt like mange molekyler kolliderer med som unnslipper væsken eller det faste stoffet, har det oppstått likevekt mellom væsken/faststoffet og gassen ovenfor. Trykket i gassen kalles da dens damptrykk.
Vanlig luft har et trykk P0 på en atmosfære (101 325 Pa), og til dette bidrar både vanndamp og andre gasser (mest nitrogen og oksygen). Dersom de andre gassene holder trykket Pg, så sier Daltons lov om partialtrykk at vanndampen har damptrykket Pd=P0-Pg ved likevekt.
Temperaturavhengighet
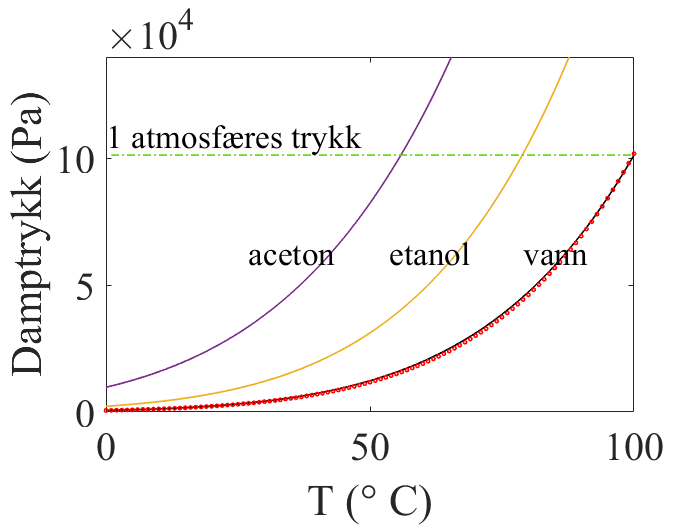
Damptrykket avhenger sterkt av temperaturen. Dersom man kjenner damptrykket P1 ved en temperatur T1, kan man finne damptrykket P2 ved en annen temperatur T2 ved å benytte Clausius-Clapeyron-ligningen, som gir
\[ln (\frac{P_1}{P_2} )= \frac{\Delta H_{vap}}{R} (\frac{1}{T_2} -\frac{1}{T_1}) \]
Her er R = 8,314 J mol−1 K−1 gasskonstanten og ΔHvap er fordampingsvarmen. Clausius-Clapeyron-ligningen er en enkel modell for damptrykket, og det finnes mange mer komplekse modeller. Imidlertid kan man bruke Clausius-Clapeyron-ligningen til å bestemme fordampingsvarmen ved å måle damptrykket og temperaturen. Damptrykket avhenger ikke av overflatearealet til væsken eller hvor mye væske det er i beholderen. Damptrykket øker omtrent eksponentielt med temperaturen. Når damptrykket er en atmosfære er man ved normalkokepunktet, og væsken vil begynne å koke.
Krefter mellom molekyler bestemmer damptrykket
Dersom vekselvirkningene mellom molekylene i væsken er sterke vil damptrykket være lavt, mens dersom de er svake vil damptrykket være høyt og væsken kalles gjerne lettflyktig. Dette gjelder for eksempel aceton, som har normalkokepunkt 329 K og fordampingsvarme 31,3 kJ/mol. Vann har til sammenligning normalkokepunkt 373 K og fordampingsvarme 40,7 kJ/mol, og vil derfor ha betydelig mindre damptrykk. Flytende metaller, som for eksempel kvikksølv, har ofte veldig lavt damptrykk.
Les mer i Store norske leksikon




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.