Kalorimeter er et apparat til måling av varme. Et kalorimeter kan brukes til å måle hvor mye energi som avgis i en kjemisk reaksjon eller varmekapasiteten til et stoff.
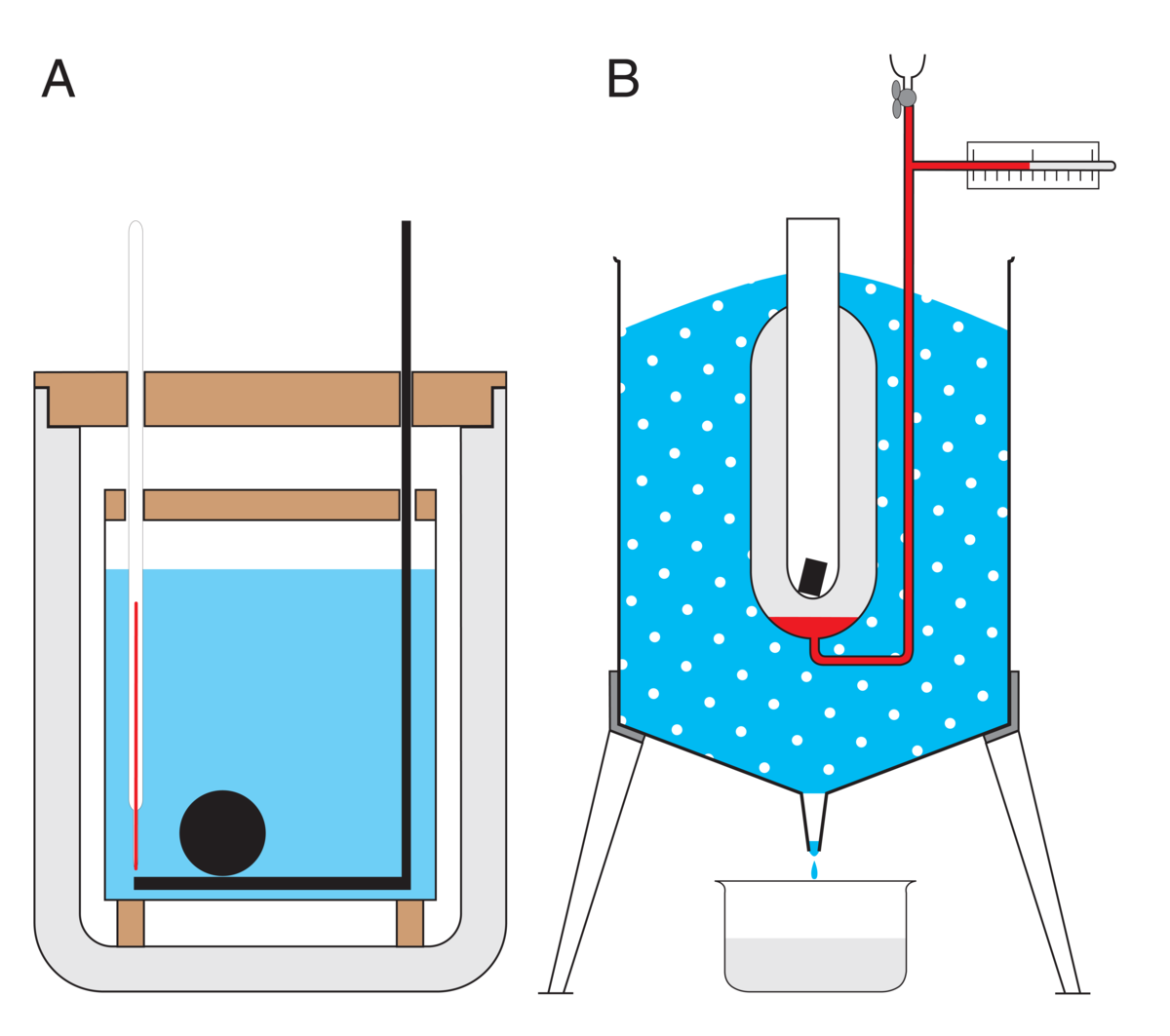
To enkle kalorimetre er vist i figuren. I vannkalorimeteret som er plassert under bokstaven A måler et termometer temperaturen i vannet. For at vannets temperatur skal være mest mulig skjermet fra omgivelsene, er vannbadet plassert inne i en beholder som er varmeisolert fra omgivelsene. Ved å introdusere den sorte kulen får man en endring i temperaturen i vannet. Dette kan skje for eksempel ved at den sorte kulen først varmes opp til en høy temperatur, og deretter plasseres i vannet. Alternativt kan man la kulen være hul og romme kjemikalier. En kjemisk reaksjon settes så i gang, og temperaturen i kuleoverflaten og deretter vannet øker, og denne temperaturøkningen kan brukes til å finne varmen.
I iskalorimeteret under bokstaven B benytter man is rundt en anordning som holder på et reagensglass. En endring i reagensglasset, for eksempel et stoff ved høy temperatur eller en kjemisk reaksjon, fører til at en del av isen smelter. Vannet renner ut av beholderen, og man måler forandringen i masse. Siden smeltevarmen til is er 334 joule per gram (3,34· 105 J/kg), kan man bruke dette tapet av masse til å finne varmen. På denne måten kan man for eksempel bestemme varmekapasiteten til materialet i reagensglasset.
De fleste kalorimeter som brukes i vitenskap og industri er mer komplisert bygd opp enn de vist i figuren, men prinsippet er det samme; nemlig å måle varme.
Navnet kalorimeter kommer fra den gang man trodde varme var et stoff (kalorikk), og det har blitt beholdt på apparater som er konstruert for å måle temperaturforandringer, enten det blir målt ved prosesser i kalorimeteret eller når energi tilføres prøven i kalorimeteret utenfra. Fra slike målinger kan forskjellige termodynamiske parametere for prøven beregnes som entalpi- og entropi-forandringer.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.