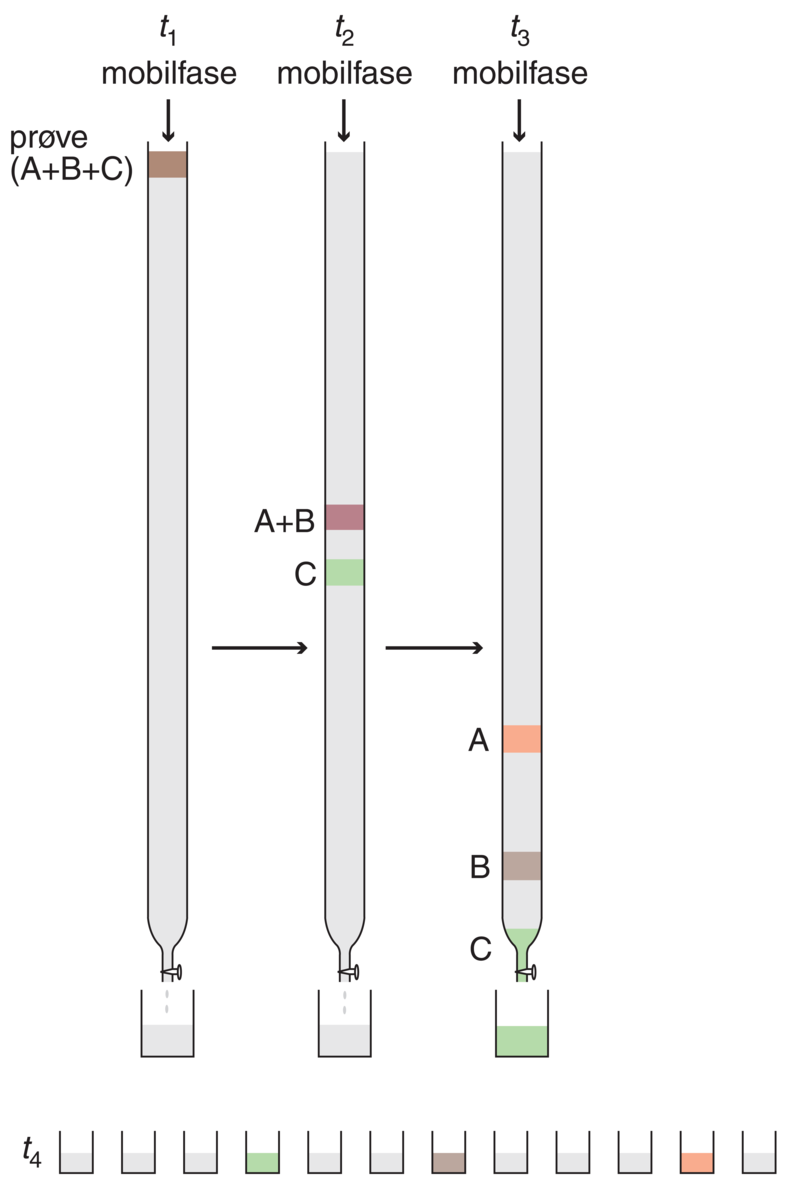
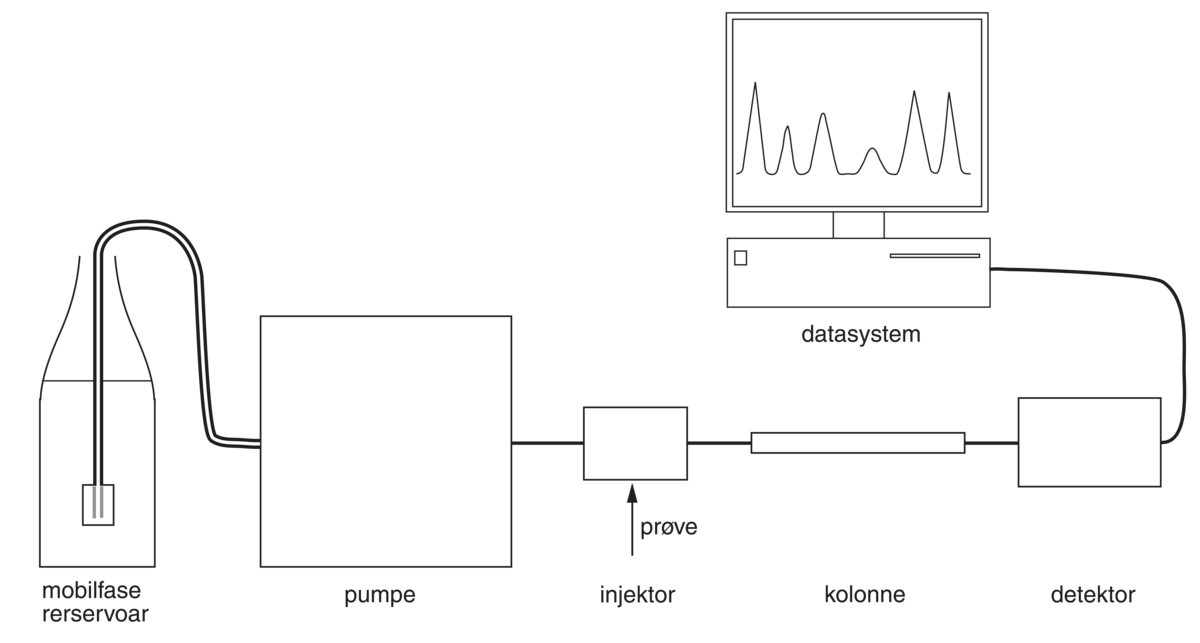
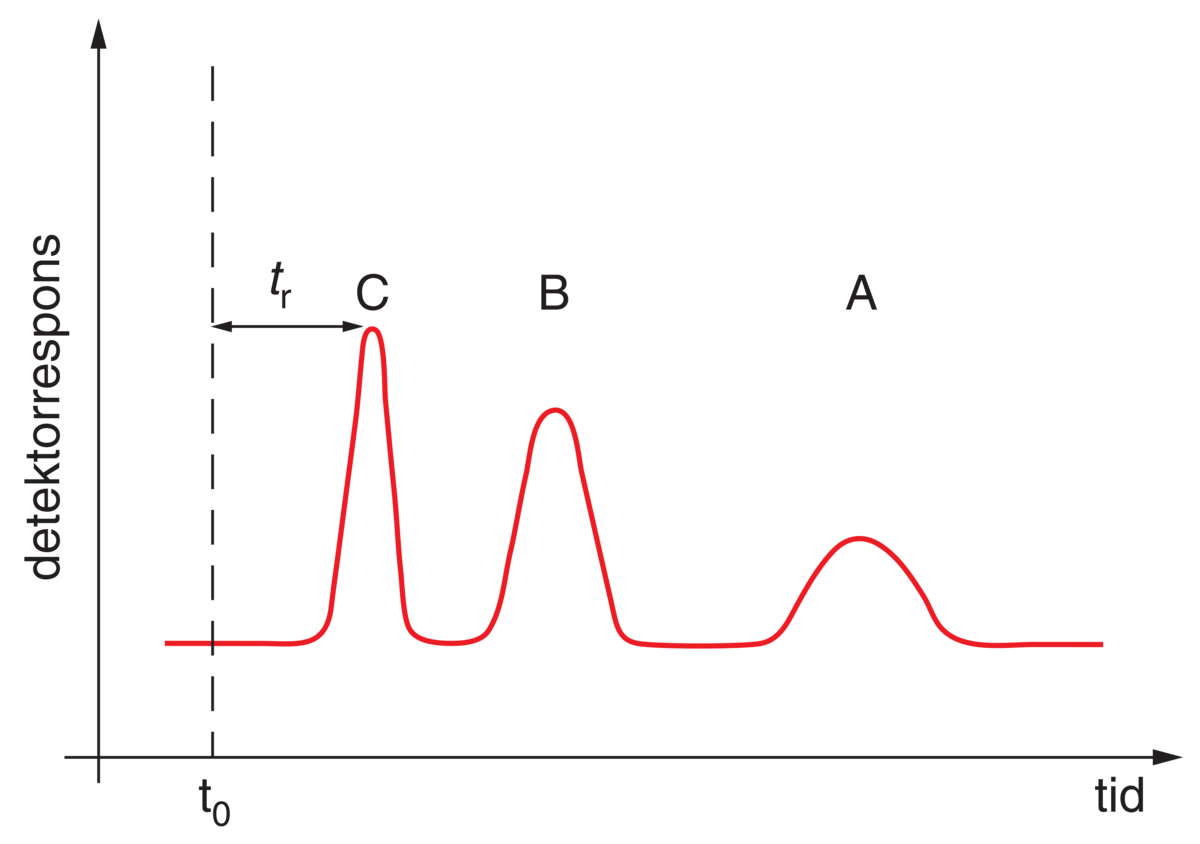
Kromatografi er metoder for separasjon av kjemiske stoffer mellom to faser, én fase som beveger seg (flytende eller gass) i en bestemt retning og én fase som står stille (fast eller gummiaktig).
Et eksempel på kromatografi er når et ark kommet bort i noe vannsøl, vann trekker inn i papiret og tusjflekker på papiret vil bli trukket bortetter sammen med vannet og separert i ulike farger. Selv om dette oftest skjer når man søler vann ved et uhell, så er det samtidig en kromatografimetode, papirkromatografi, som tidligere var mye benytta.
Kromatografi brukes ofte for å analysere en prøve for å finne ut om den inneholder et bestemt stoff, og i så fall, hvor mye av dette stoffet. Slike analyser brukes for eksempel til å bestemme mengden forurensning i en jordprøve, konsentrasjonen av et legemiddel i en blodprøve eller mengden av et forbudt stoff i en dopingprøve.
Kromatografi kan også brukes til å bestemme sammensetning av ulike stoffer i en blanding, for eksempel å bestemme andelen av metta, enumetta eller flerumetta fettsyrer i ulike typer matolje.
I noen tilfeller blir kromatografi også benytta til å separere ulike stoffer fra hverandre, for å studere hvert av de rene stoffene videre. Dette skjer på forskningslaboratorier når en blanding av stoffer inneholder noen milligram eller mikrogram av hvert enkelt stoff. Kromatografi er for upraktisk og for kostbart til å bli brukt for å separere mengder på noen få gram eller mer. Da vil andre separasjonsmetoder som for eksempel destillasjon eller utfelling brukes.





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.