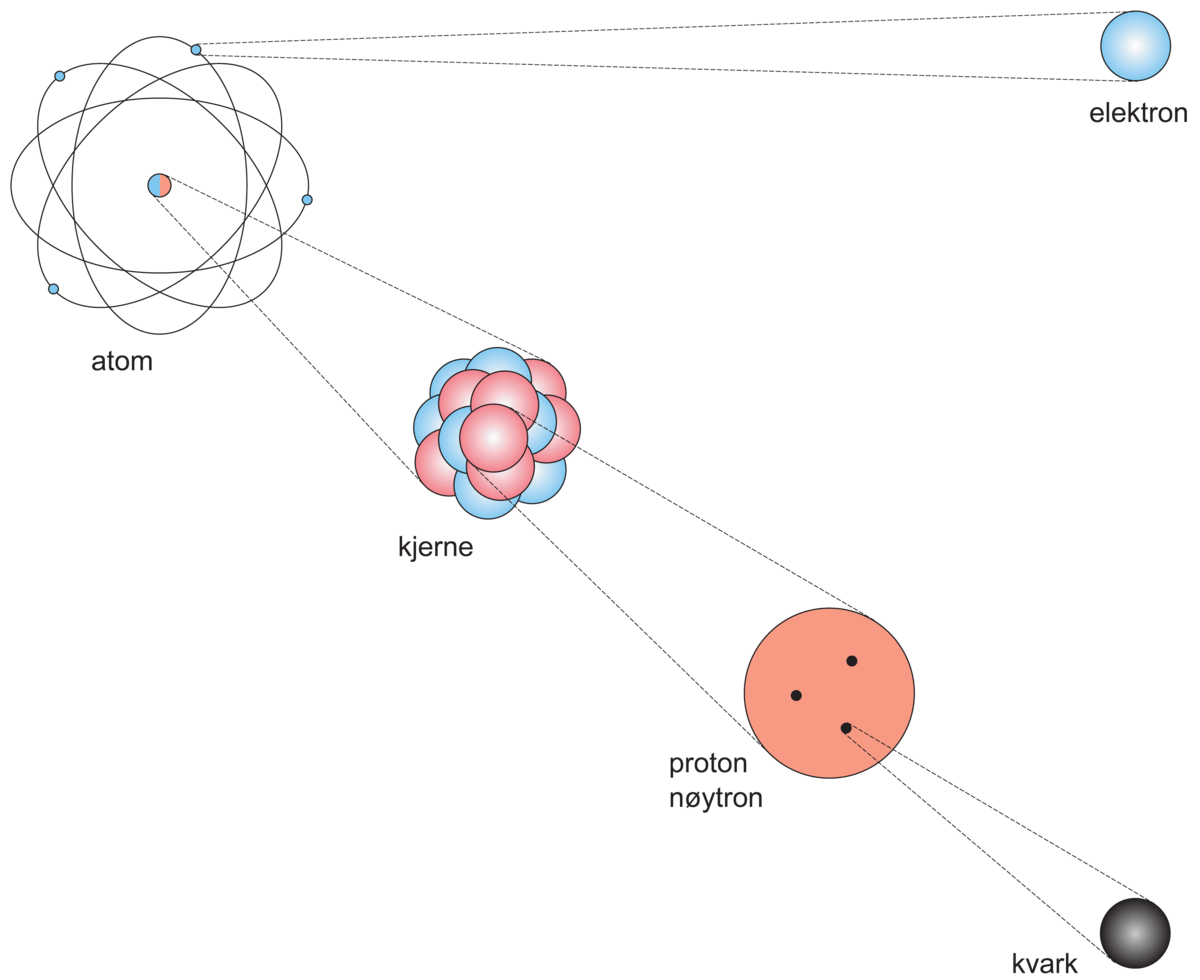
Atom er den minste mengden av et grunnstoff. Alt stoff består av atomer.
Atomet er bygd opp av en kjerne som igjen er bygd opp av protoner, og nøytroner. Disse er igjen bygd opp av kvarker. Rundt kjernen har atomet ei «sky» av elektroner. Protonene i kjernen har positiv elektrisk ladning og nøytronene har nøytral ladning. Derfor har atomkjernen positiv ladning. Elektronene har derimot negativ elektrisk ladning.
Atomkjernen er udelelig ved kjemiske reaksjoner. Men protoner eller nøytroner kan rives løs fra kjernen dersom atomet bombarderes utafra med ulike partikler. Atomkjerner av noen grunnstoff kan også endre seg uten påvirkning utafra. Det skjer gjennom radioaktive prosesser (se grunnstoffomdanning).
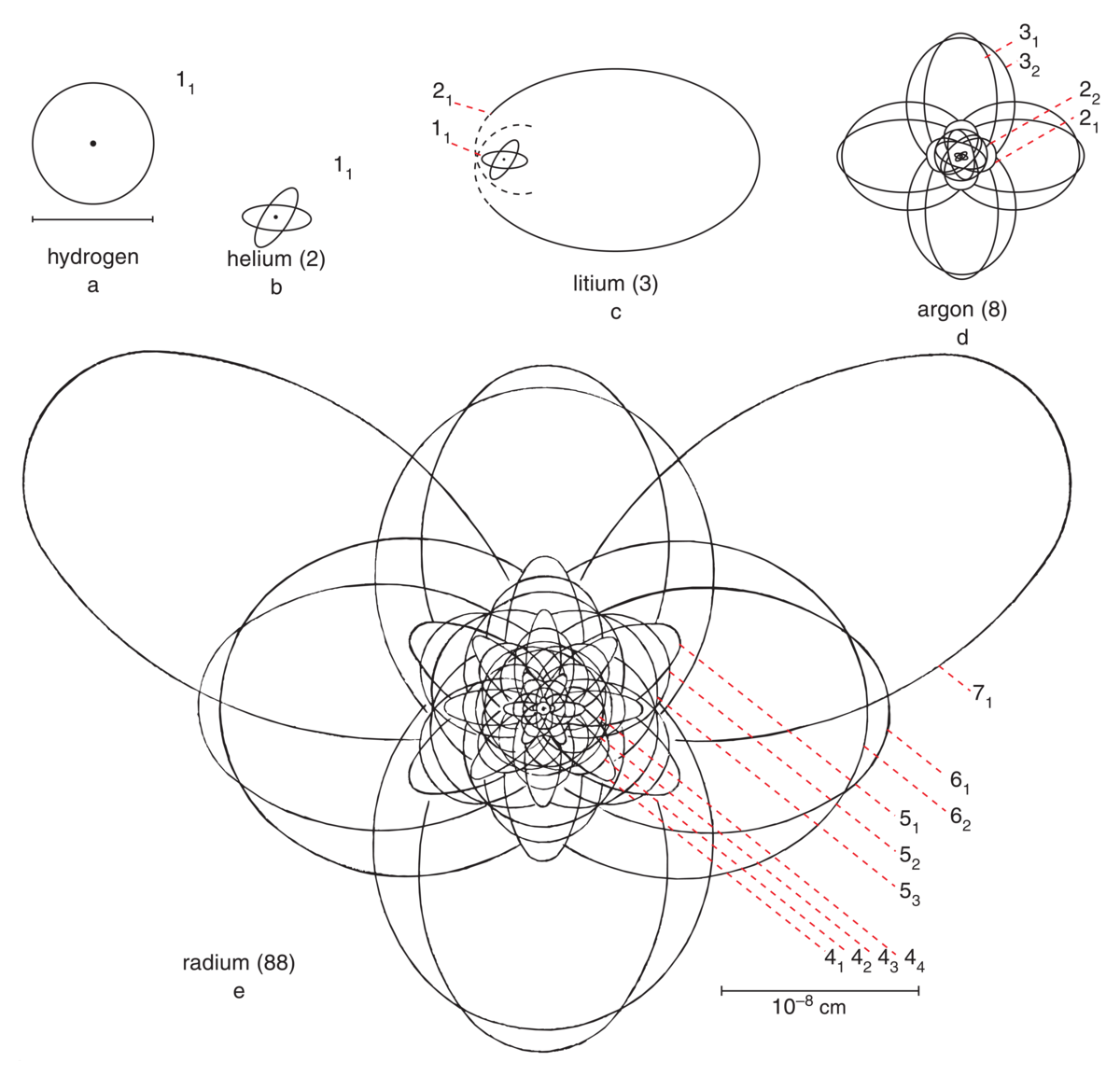
Atomets størrelse bestemmes av kjernen og elektronfordelinga. Størrelsen varierer fra 0,1 nanometer til noen få ganger større. Dette betyr at en må legge rundt 100 millioner atomer etter hverandre i rekke for hver centimeter.





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.