En gass har ingen overflate, slik som væsker og faste stoffer. I en gass er molekylene i konstant bevegelse, men kan kollidere med hverandre eller omgivelsene.
En ideal gass er en gass hvor vi ser bort fra kreftene mellom molekylene i gassen så lenge de ikke kolliderer. Det vil si at molekylene bare utsettes for krefter i kollisjonsøyeblikket. Selv om man ofte kan tenke seg at dette er tilfelle så lenge trykket ikke er for høyt og temperaturen tilstrekkelig langt over kokepunktet, så vil likevel de fleste gasser avvike noe i egenskaper fra en ideal gass.
En gass øver alltid et trykk mot overflaten til gjenstander som befinner seg i den og øver alltid et trykk mot veggene til rommet den er i. En gass fyller alltid den beholderen den er i. Dersom veggene gir etter for trykket, utvider gassen seg.
Gass-tilstandsligningen kan brukes til å finne relasjonen mellom trykk, volum og temperatur i ulike gasser. Dersom gassens trykk og volum endres mens temperaturen er konstant, kalles prosessen isoterm. Dersom trykket holdes uforandret mens temperaturen og volumet endres, kalles prosessen isobar. Dersom gassens volum holdes konstant mens trykket og temperaturen endres, kalles prosessen isochor.
Hvis en gass endrer trykk, temperatur eller volum uten at den utveksler varme med omgivelsene, kalles forandringene adiabatiske. Når en gass utvider seg uten overføring av varme, blir den avkjølt, og når den trykkes sammen, stiger temperaturen. Det tar tid å overføre varme, så raske prosesser, for eksempel trykkendringene i lydbølger i luft, kan regnes som adiabatiske.
Enkelte gasser kan man se med øyet. For eksempel har klor en svakt gulgrønn farge, mens jodgass har en intens fiolett farge. De fleste vanlige gasser er imidlertid usynlige for øyet. Karbondioksid er for eksempel usynlig for øyet, men man kan finne ut hvor mye og hva slags tilstand gassen er i ved hjelp av infrarød spektroskopi.



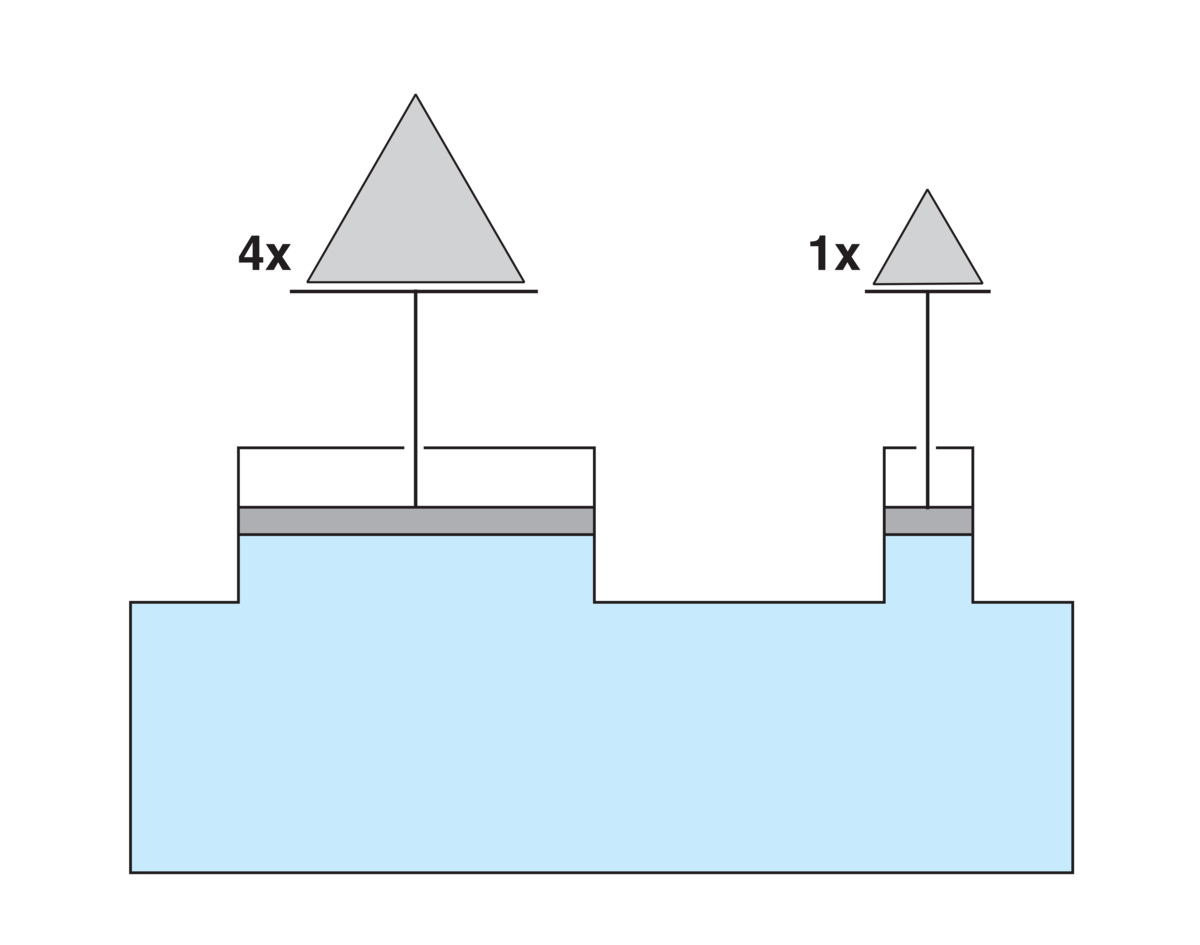



Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.