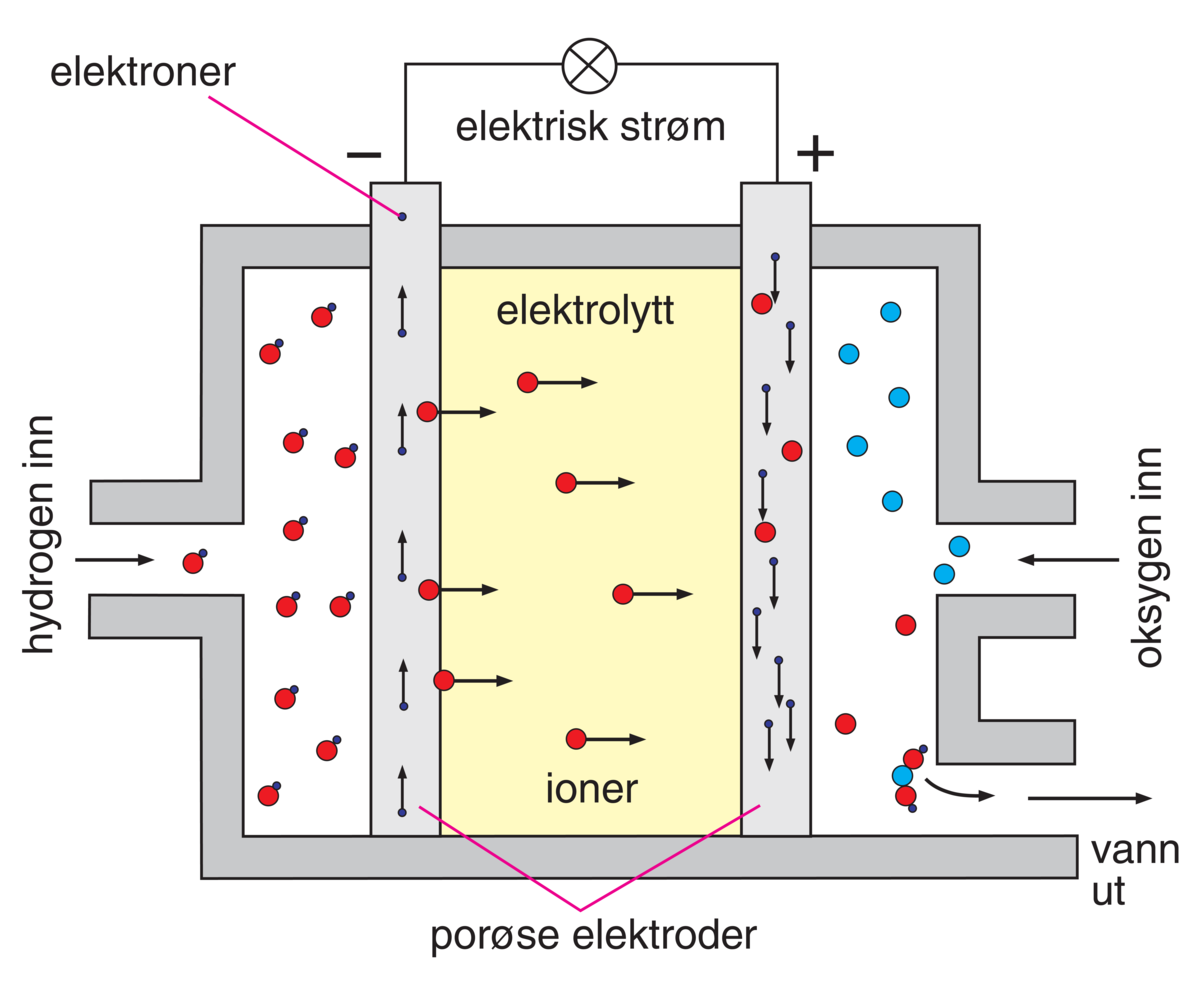
Under drift vil cellen lett polariseres. Da synker spenningen sterkt. Den må derfor ikke belastes for mye. Både av den grunn, og for å unngå energitap som følge av varmeutvikling i cellen, lager man elektrodene av store, parallelle plater med liten avstand mellom. Strømtettheten i cellen er vanligvis under 0,1 ampere per kvadratcentimeter.
Brenselceller er lettere enn noe annet elektrokjemisk element med tilsvarende kapasitet. Mens blyakkumulatorer med en kapasitet på 1 kilowattimer veier om lag 50 kilogram, kan brenselceller med samme kapasitet lages med en vekt på bare 7 kilogram. Vekten av brenselet, hydrogen og oksygen som omsettes til vann, utgjør rundt ½ kilogram per kilowattimer. For et system som skal være i langvarig bruk vil likevel vekten av brenselet som må følge med bli betydelig.
Brenselceller arbeider lydløst og trenger liten plass.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.