Når et stoff tar opp elektroner, blir det redusert. Når et stoff gir fra seg elektroner, blir det oksidert. De to prosessene skjer alltid samtidig. Det er derfor umulig å ha en reduksjon uten en oksidasjon, og omvendt.
- Reduksjon er opptak av elektroner
- Oksidasjon er avgivelse av elektroner
I noen enkle tilfeller følger det logisk at en redoksreaksjon har skjedd.
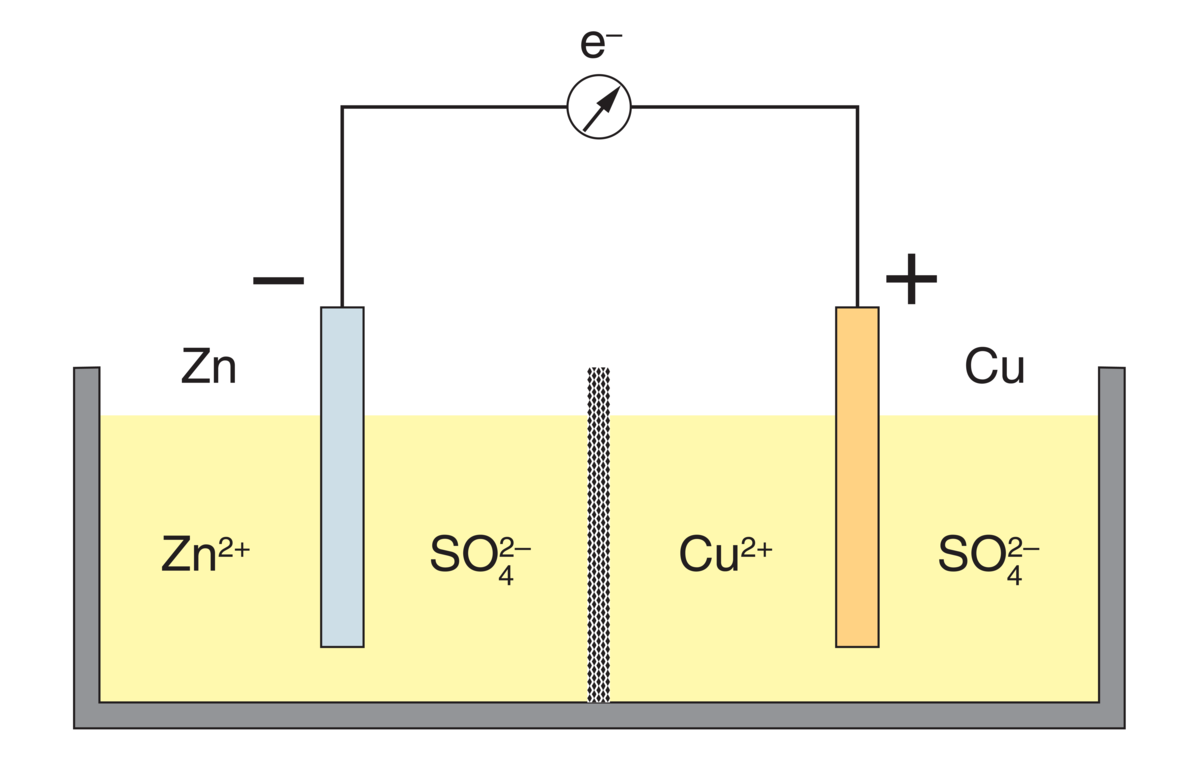
Hvis sinkmetall (Zn) blir behandlet med en løsning med kobberioner (Cu2+), så vil det over tid dannes kobbermetall, og sinkmetallet blir spist opp. Det betyr at sink er omdannet til sinkioner (altså mistet to elektroner og blitt oksidert), mens kobberioner har blitt omdannet til kobber (altså tatt opp to elektroner og blitt redusert). Siden det er snakk om elektronoverføring, er dette en redoksreaksjon.
Zn(s) + Cu2+(aq) → Zn2+(aq)+ Cu(s)
Et reduksjonsmiddel er et stoff som kan redusere et annet og derved selv bli oksidert. I eksemplet over er sink et reduksjonsmiddelet som reduserer kobberioner til kobber. Samtidig blir sink selv oksidert til sinkioner.
Tilsvarende er et oksidasjonsmiddel et stoff som kan oksidere et annet og selv bli redusert. I eksemplet ovenfor er kobberioner oksidasjonsmiddelet som oksiderer sink til sinkioner.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.