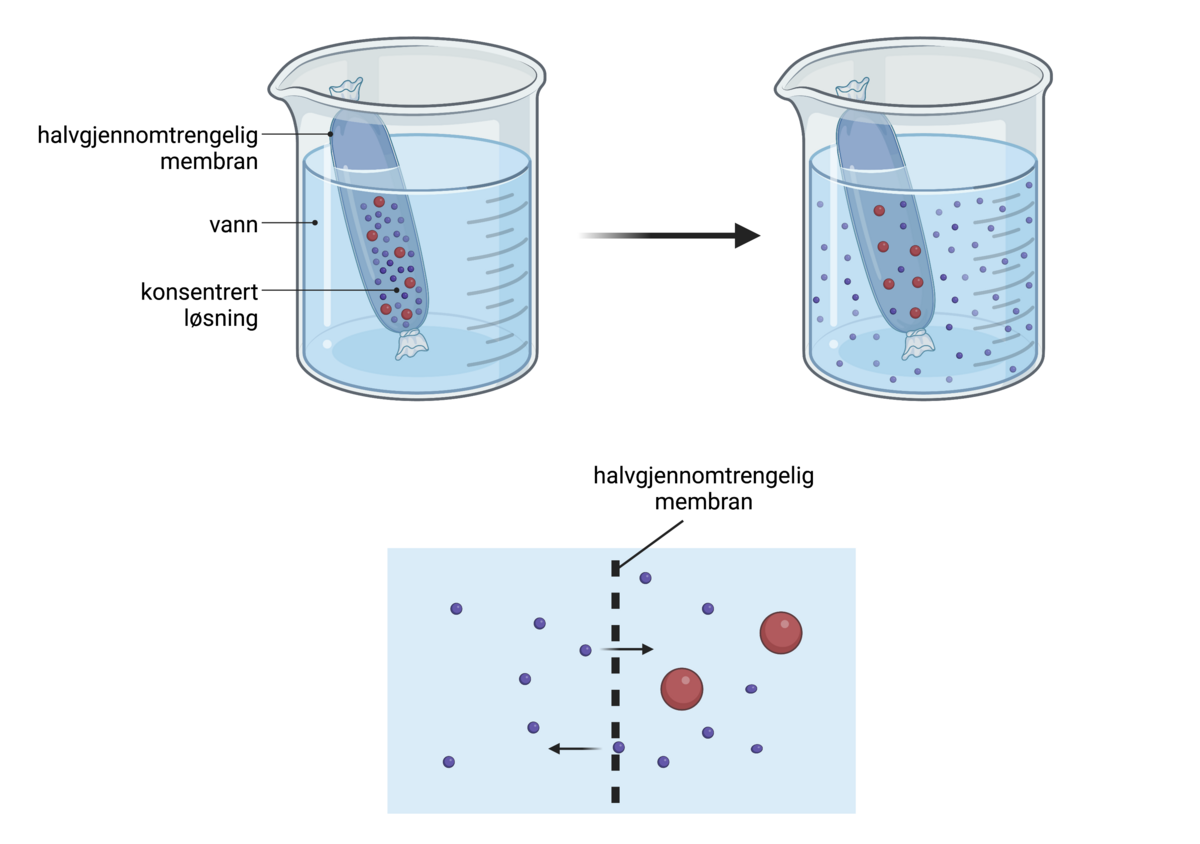
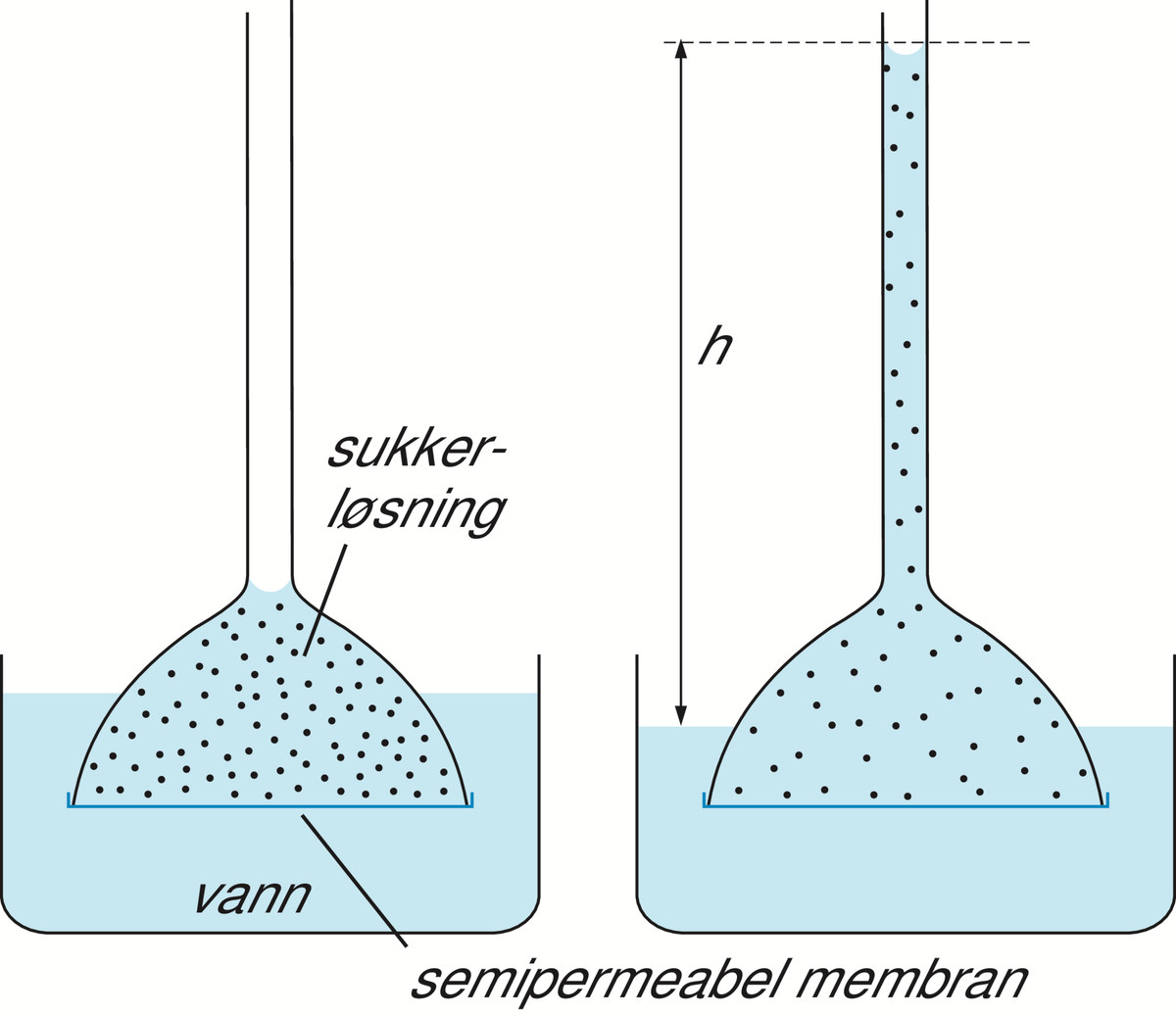
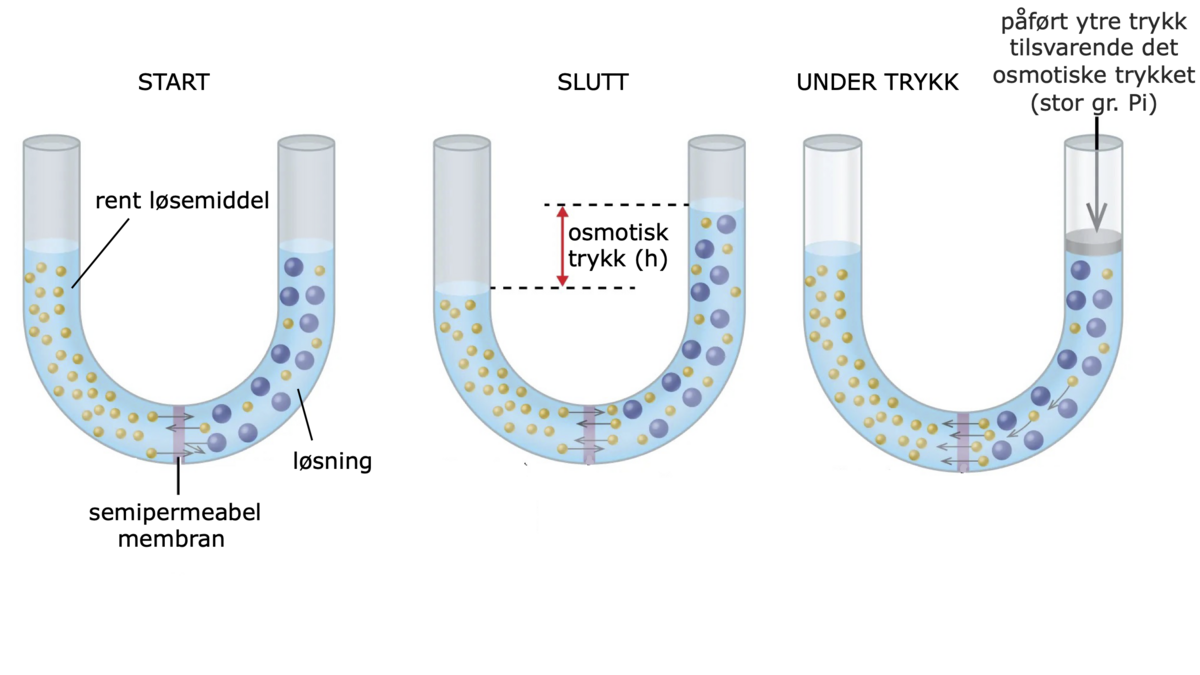
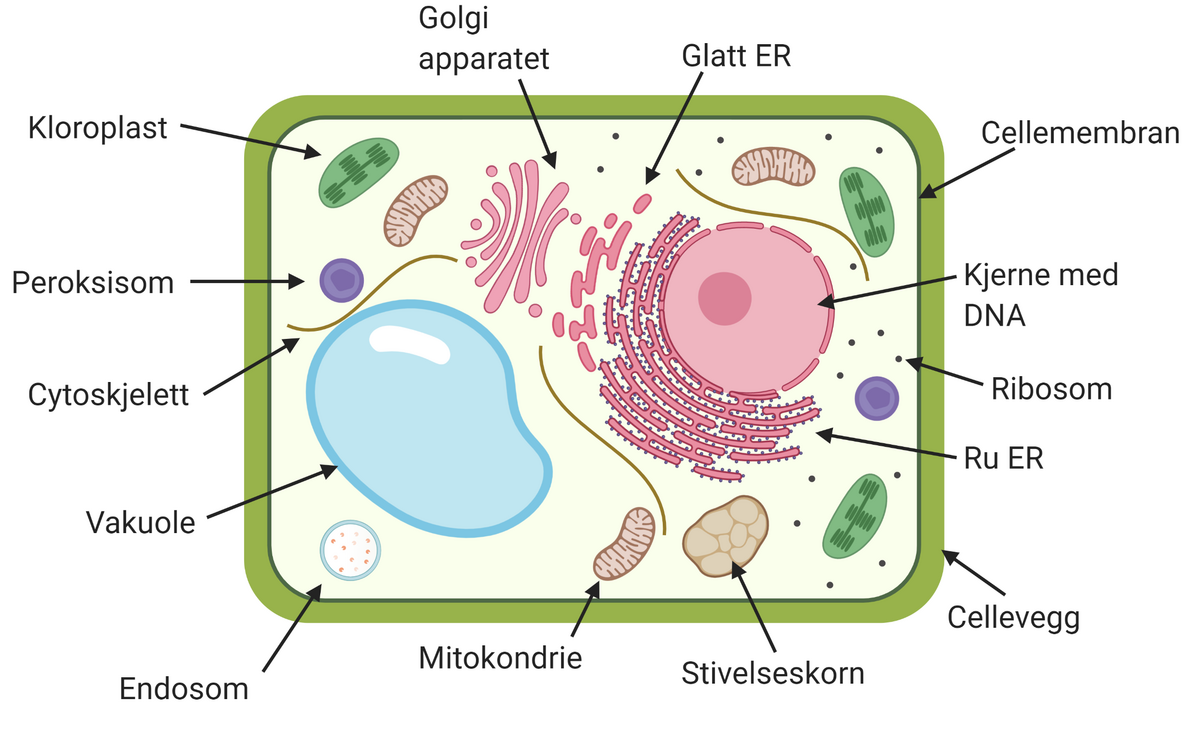
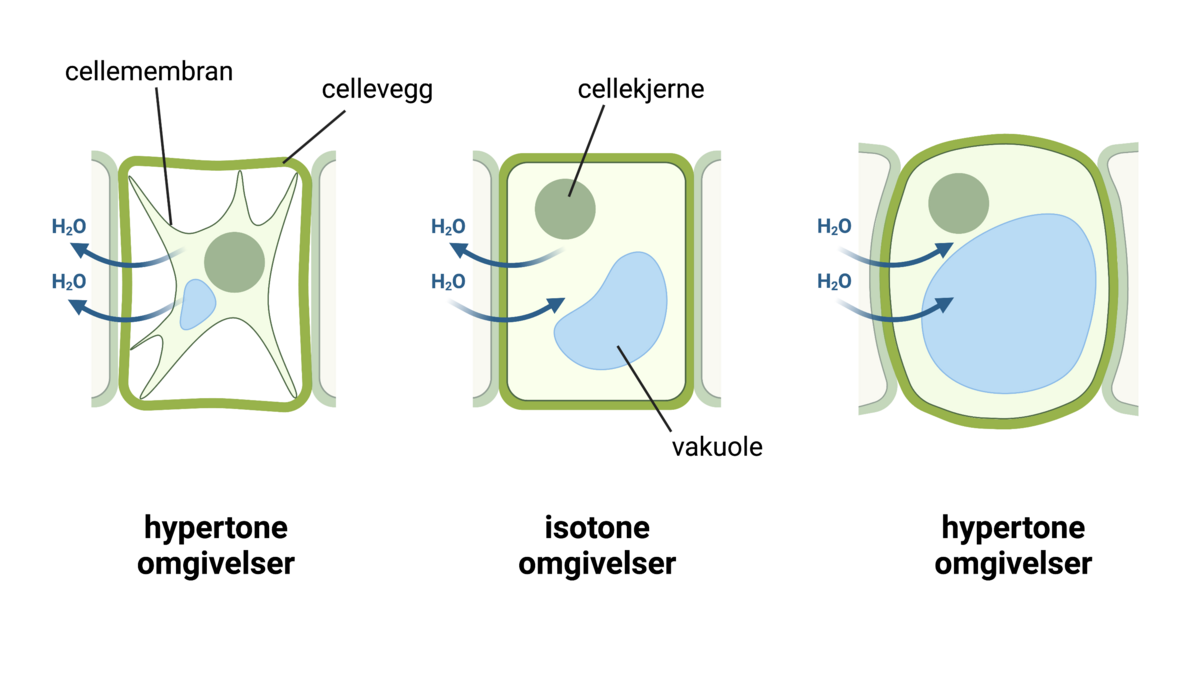
Osmose er den spontane vandringen av løsemiddel gjennom en membran. Osmotisk drevet transport oppstår gjennom en membran som skiller to løsninger med ulik konsentrasjon av et oppløst stoff. Membranen må ha den egenskapen at det oppløste stoffet ikke kan passere gjennom membranen, men at løsemiddelet kan. En slik membran kalles en semipermeabel membran. Når de to løsningene har kommet i likevekt med hverandre har konsentrasjonen i begge blitt like stor og det har skjedd en netto økning av volumet i den opprinnelig mest konsentrerte løsningen, og en tilsvarende minking av volumet av den minst konsentrerte.
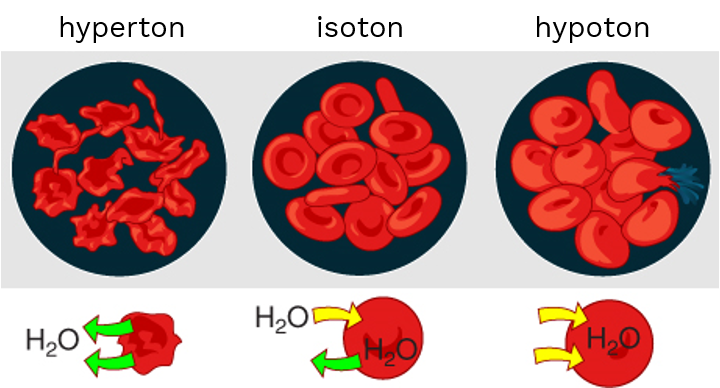
Osmose er viktig i biologiske systemer. Hvis konsentrasjonen av løste stoffer utenfor en celle avtar, vil cellen svelle ved at vann trekkes inn fordi cellemembranen er semipermeabel. Osmose er også viktig i de minste blodårene, kapillarene. Blodtrykket presser væske ut gjennom veggen i kapillarene. Dette motvirkes av den osmotiske effekten av proteiner i blodet, særlig albumin.
Osmose er viktig ved bestemmelse av molekylvekt av makromolekyler og ved dialyse, og danner prinsippet for membranfiltrering for en rekke praktiske formål som vannrensing og avsalting av havvann til drikkevann






Kommentarer (3)
skrev Halvard Baugerød
skrev Torbjørn Koch
Hei! Er ikke den første setningen litt upresis? "Osmose er diffusjon av molekyler gjennom en membran" står det. Det er jo MANGE former for diffusjon av molekyler gjennom cellemembraner som IKKE er osmose. Burde det ikke stått "Osmose er diffusjon av VANNMOLEKYLER gjennom en HALVGJENNOMTRENGELIG membran"?
Mvh Torbjørn Koch
svarte Anne Eilertsen
Hei, og takk for innspillet! Det trenger vel ikke nødvendigvis å være vannmolekyler, selv om det ofte er vann som er løsemiddelet, men det er ganske riktig snakk om en semipermeabel (halvgjennomtrengelig) membran, som det også står i de neste setningene. Grunnen til at dette ordet ikke stod i første setning, var nok å gjøre innledningen enklere å lese for folk som ikke kjenner til begrepet, og så valgte vi å forklare det i de etterfølgende setningene i stedet, men du kan ha rett i at det er tydeligere å ta med «halvgjennomtrengelig». Vi har derfor endret setningen litt.
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.