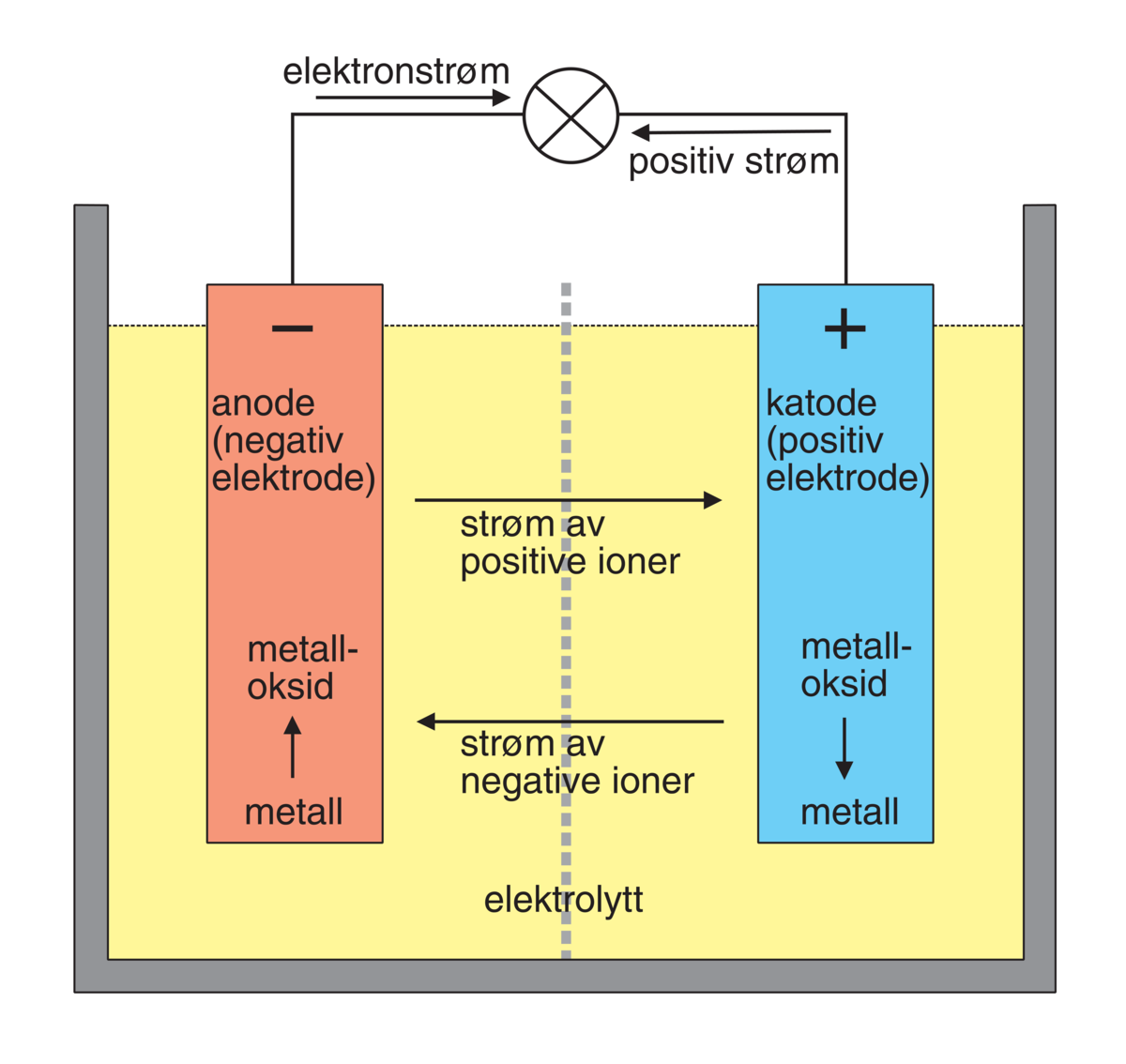
Batteri er en innretning som omformer kjemisk energi direkte til elektrisk energi. Det består av en elektrokjemisk celle med to elektroder og en elektrolytt. Ved elektrodene skjer det spontane reaksjoner ved utlading.
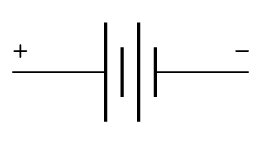
Et batteri består av én eller flere galvaniske elementer eller celler, med en bestemt cellespenning. Det vil gå en strøm mellom elektrodene. Elektrodene knyttes til en ytre leder for å levere strøm.
Den italienske fysikeren Alessandro Volta var den første som demonstrerte batterieffekten ved å koble sammen elektroder av kobber og sink med en elektrolytt. En såkalt Volta-søyle for generering av elektrisitet ble konstruert ved å seriekoble flere elektroder.
Det er vanlig å skille mellom to hovedtyper batterier:
- primærbatterier, som er engangsbatterier
- sekundærbatterier, som er oppladbare batterier
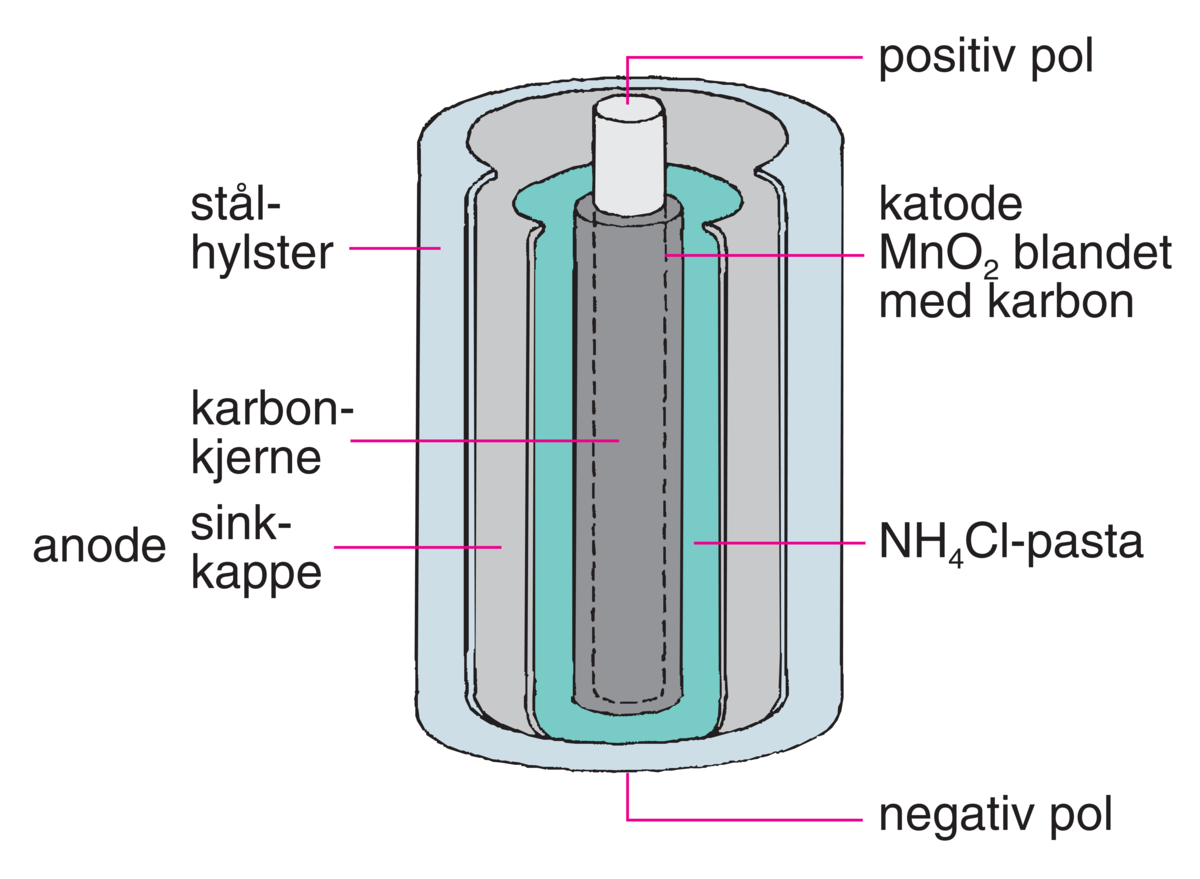
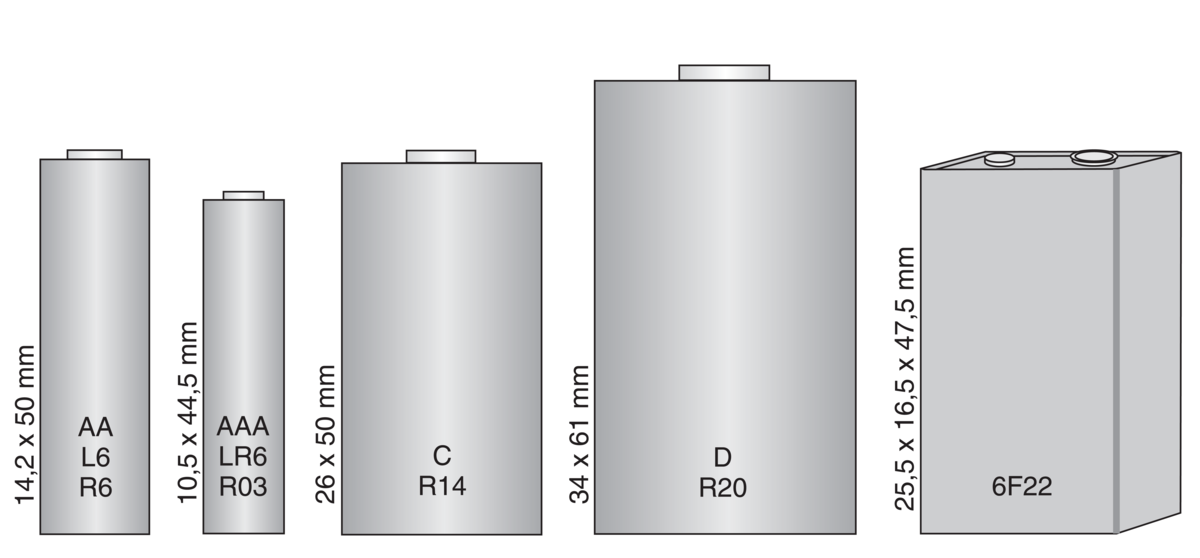
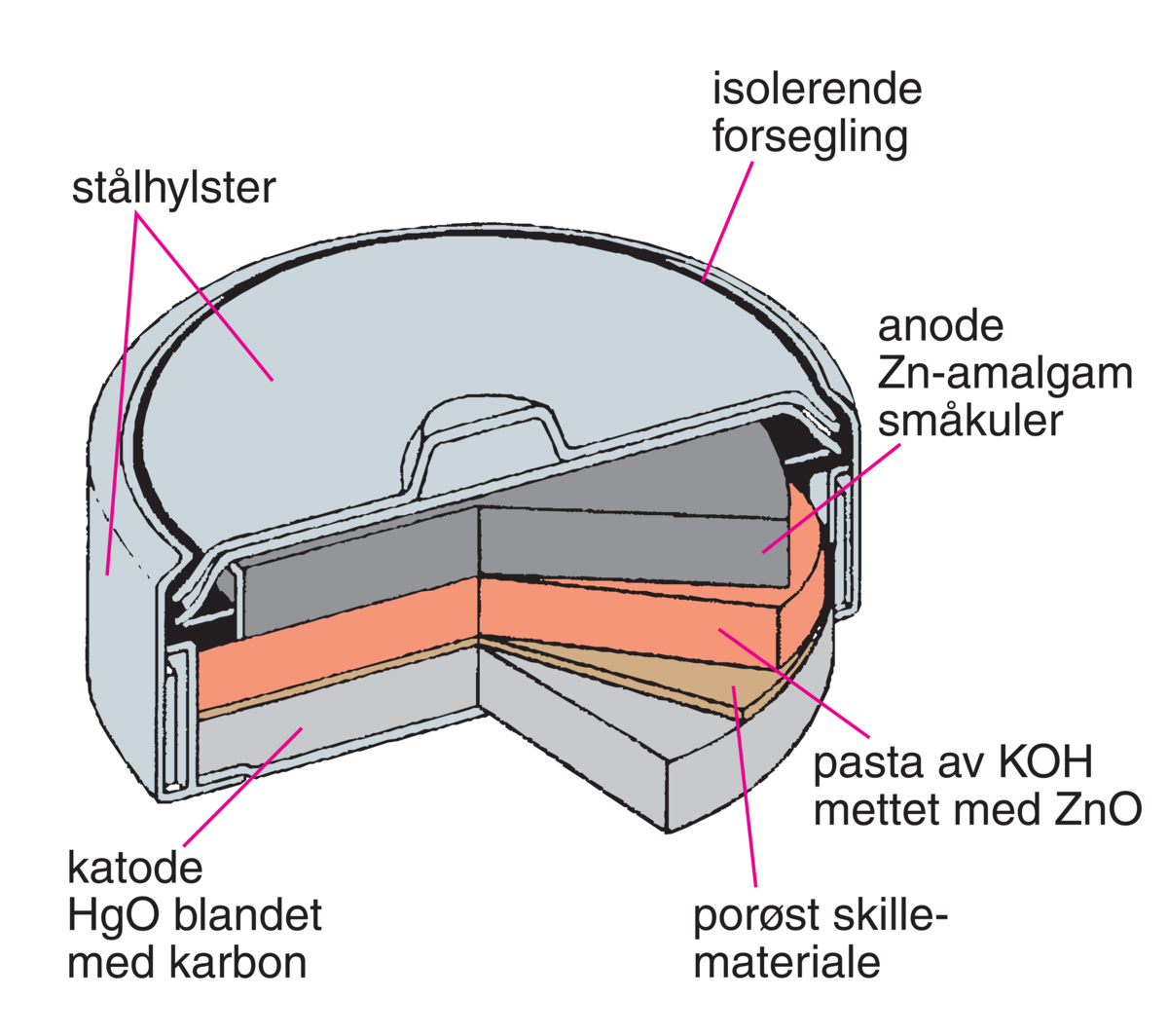
Et primærbatteri kan ikke lades opp, og må derfor kastes eller resirkuleres etter at reaktantene er brukt opp. Alkaliske primærbatterier er fortsatt viktig til bruk i små enheter. Det finnes mange ulike oppladbare batterier som kan ha svært lang levetid.













Kommentarer (3)
skrev Steinar Mathiesen
skrev Malin Pedersen
svarte Knut A. Rosvold
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.