Lyshøsting er prosessen der energi fra sollys fanges og omdannes til kjemisk energi i fotosyntesen. Lyshøstingen skjer ved hjelp av fargestoffer (også kalt pigmenter), som kan absorbere lysenergi. Prosessen skjer i kloroplastene i planteceller, og i noen typer bakterier.
lyshøsting (fotosyntese)
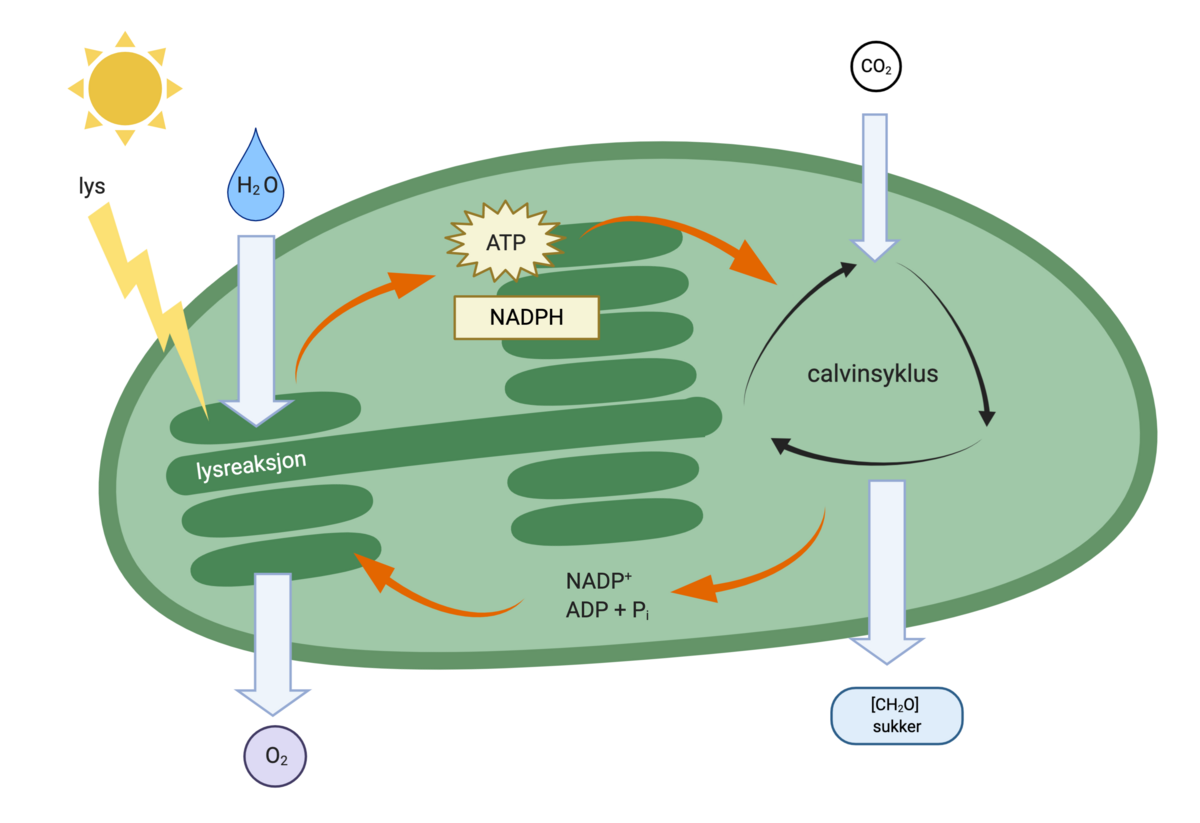
Hos alger og planter skjer lyshøstingen i fotosyntesen i kloroplasteene. Lyshøsting er prosessen der energi fra sollys fanges og omdannes til kjemisk energi i fotosyntesen. Lyshøstingen skjer ved hjelp av fargestoffer (også kalt pigmenter), som kan absorbere lysenergi.
Absorpsjon av lysenergi
Pigmenter er molekyler som kan absorbere lysenergi. En enhet lysenergi kalles et foton (hν). Når pigmentet absorberer et foton endres pigmentet fra grunntilstanden med elektroner i molekylorbitaler med lavt energinivå (pigment) til et eksitert nivå (pigment*), hvor et elektron har fått et høyere energinivå:
pigment + hν → pigment*
Overgangen til et eksitert nivå følger kvantemekaniske lover, og skjer bare hvis lysenergien til fotonet passer nøyaktige til forskjellen i energinivå fra grunntilstand til eksitert nivå for elektronet.
Elektronenes betydning
I karbon-dobbeltbindingene er det delokaliserte pi-elektroner (π-elektroner) i molekylorbitaler, i alt 24 pi-elektroner. I hver pi-orbital er det to elektroner med motsatte spinn. Det betyr at det for eksitert klorofyll er to eksiterte nivåer, andre singlett hvor blått lys har nok energi til å eksitere, og første singlett, et lavere nivå hvor rødt lys har nok energi til å eksitere. Singlett vil si at molekylet i den høyeste opptatte molekylorbitalen (HOMO) har et elektronpar med motsatte antiparallelle spinn.
Det eksiterte elektronet og elektronet som blir igjen i grunntilstanden har motsatt spinn. Levetiden for andre singlett er meget kort, og elektronet faller ned til første singlett og kvitter seg med energiforskjellen mellom disse to nivåene i form av varme og vibrasjon.
Et π-elektron i grunntilstanden som blir truffet av et foton blir eksitert til en π-antibindende orbital (π∗). En molekylorbital angir sannsynlighetstettheten for å treffe på et elektron i molekylet. Eksitasjonsenergien kan bli overført til andre klorofyllmolekyler ved resonans.
Ifølge Franck-Codon-prinsippet er absorpsjonen og emisjonen av lyskvantet meget rask, og skjer i løpet av picosekunder (1 ps = 10-12 s) sammenlignet med hastigheten til molekylære vibrasjoner. Energien kan derfor overføres fra et eksitert pigment til det neste ved induktiv resonans (Förster resonansenergioverføring).
Dette forutsetter tilstrekkelig nærhet mellom molekylene, og gunstig romlig orientering. Eksitasjonsenergien blir via flere klorofyllmolekyler overført til et eksitert reaksjonssenterklorofyll, P680* i fotosystem II og P700* i fotosystem I. Disse er spesielle klorofyll a-molekyler som kan avgi et elektron (e-) i en ladningsseparasjon
P680* → P680+ + e-
Eksitert P680* reduserer elektronakseptoren feofytin, og derved er lysenergi omdannet til kjemisk energi. Feofytin er et klorofyllmolekyl hvor magnesium (Mg2+) i kjernen er fjernet. Feofytin er den formen av klorofyll som mottar elektroner fra eksitert reaksjonssenterklorofyll, og fanger og fikserer derved lysenergien. Det avgitte elektronet fra P680* blir erstattet med et elektron som kommer fra oksidasjon av vann. Feofytin uten fytolhalen kalles feoforbid.
Organiske ringstrukturer med konjugerte dobbeltbindinger, det vil si vekslende karbon-karbon dobbeltbindinger (-C=C-) og karbon enkeltbindinger, er stabilisert via resonans. Jo flere dobbeltbindinger det er i et molekyl, desto mer skifter absorpsjonen av elektromagnetisk stråling fra ultrafiolett mot synlig lys. Konjugerte dobbeltbindinger gjør at de eksiterte energinivåene til elektronene splittes i flere nivåer og det blir mindre energisprang mellom grunnivå og eksitert nivå i klorofyll.
I porfyrinkjernen med de fire tetrapyrrolringene i klorofyll, er det i alt tolv konjugerte karbon-karbon dobbeltbindinger, med 24 pi (π)-elektroner, hvor hvert av disse elektronene har en mulighet til å bli eksitert til et høyere energinivå hvis det blir truffet av et foton eller lyskvant.
Absorpsjonstopper hos klorofyll
Den første absorpsjonstoppen i blått kalles Soret-bånd (etter Jacque-Louis Soret), som skyldes en transisjon av et π−elektron til en eksitert tilstand π∗ . For eksempel har klorofyll a i en acetonløsning et absorpsjonsmaksimum i rødt lys ved cirka 663 nanometer, men ved cirka 680 nanometer i et intakt blad. I klorofyll b er de to absorpsjonsbåndene i blått og rødt tettere sammen, og gjør det mulig å overføre eksitasjonsenergi i den røde delen av spekteret fra klorofyll b til klorofyll a.
Triplett klorofyll
Klorofyll kan også finnes i en eksitert form som triplett klorofyll, hvor det eksiterte elektronet har samme spinnretning som det gjenværende elektronet i elektronparet i grunntilstanden. Triplettnivået har lavere energinvå enn singlett-tilstanden. Triplett klorofyll har lang nok levetid til å kunne overføre eksitasjonsenergien sin til oksygen og danne reaktivt singlett oksygen. Prinsippet med pigment, lys og triplett oksygen, og overføring av eksitasjonsenergi og dannelse av singlett oksygen kalles fotodynamiske effekter, og blir også anvendt innen kreftbehandling.
Andre pigmenter i planter
I karotenoidet betakaroten er det i alt elleve konjugerte karbon-karbon dobbeltbindinger med 22 π-elektroner, og molekylet blir guloransje når blått lys blir absorbert. Hem i hemoglobin har 13 karbon-karbon dobbeltbindinger med i alt 26 π-elektroner og er et rødfarget molekyl. I alle organiske pigmenter som har farger, inkludert antocyaniner, betacyaniner og melaniner, finner man alternerende karbon-karbon dobbeltbindinger som gjør at synlig lys har nok energi til å eksitere molekylet, noe av lyset blir absorbert og resten blir reflektert eller transmittert.
Les mer i Store norske leksikon




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.