Orbitaler er et klassifiseringssystem av energinivåene til elektronene i atomer og molekyler. Det benyttes både i fysikk og kjemi, og er essensielt for å beskrive egenskapene som et atom eller molekyl har.
orbital
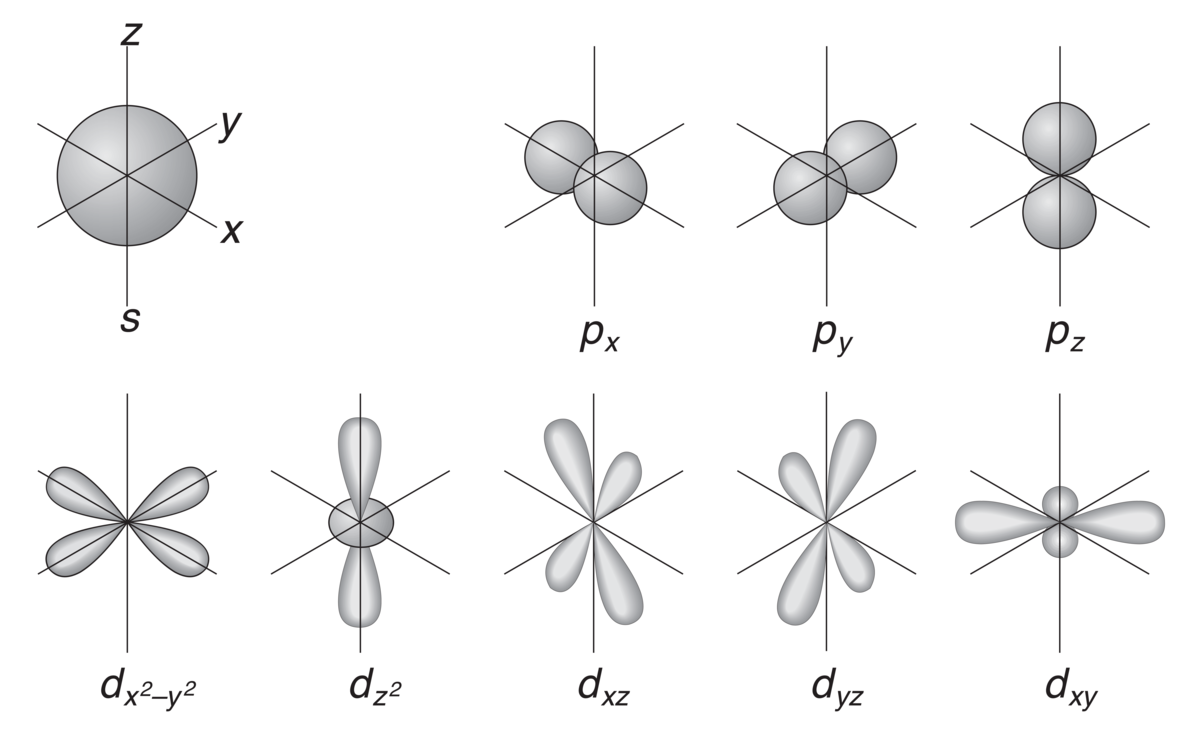
Skisse av atomorbitalenes form. Formen beregnes matematisk ved å løse den kvantefysiske Schrödingerlikningen, og beskriver sannsynligheten for at elektronet befinner seg et gitt sted i atomet. Den sirkulære formen til s-orbitalen uttrykker at alle steder rundt atomkjernen er like sannsynlige med tanke på hvor elektronet befinner seg.
Atomorbitaler og molekylorbitaler
Atomer består av elektroner som omgir en kjerne av nøytroner og protoner. I klassisk fysikk ble dette systemet beskrevet som at elektronene gikk i bane rundt atomkjernen, på samme vis som planeter går rundt solen. Utviklingen av kvantefysikk på 1900-tallet endret denne modellen fundamentalt. I stedet for å gå i en bane rundt atomkjernen, er elektronene ifølge kvantefysikken spredt ut som en sky rundt kjernen, med en gitt sannsynlighet for å befinne seg på ulike steder. Dette er et eksempel på en energitilstand som elektroner kan befinne seg i.
Slike energitilstander i atomer karakteriseres ved at de kun kan ha diskrete, bestemte verdier, i stedet for vilkårlige verdier langs et kontinuerlig spekter. Tilstandene karakteriseres ytterligere ved at elektronene har en gitt dreieimpuls i forhold til atomkjernen samt et eget elektronspinn. Hver orbital defineres derfor gjennom et sett av kvantetall som beskriver energien (n), dreieimpulsen (l) og elektronspinnet (s) til elektronene.
En vanlig måte å beskrive atomorbitaler på er å bruke bokstaver i stedet for verdien for dreieimpulsen l. Dette gjøres på følgende måte: orbitaler hvor elektronene har dreieimpuls l=0 kalles for s-orbitaler, l=1 kalles for p-orbitaler mens l=2 kalles for d-orbitaler. Slik fortsetter man å tildele en bokstav for økende dreieimpuls (se «Historie» nedenfor for opprinnelsen til disse bokstavene).
Eksempel: en atomorbital 2p beskriver energien til elektronet ved kvantetallet n=2, mens dreieimpulsen til elektronet beskrives ved bokstaven p, som altså tilsvarer l=1. Jo høyere tall, jo mindre bundet er elektronet til atomet.
Antallet elektroner som får plass i en gitt orbital kommer an på verdien til dreieimpulsen l. En oversikt over antall elektroner i orbitalene med lavest energi er som følger:
n=1: l=0 har 2 elektroner
n=2: l=0 har 2 elektroner, l=1 har 6 elektroner
n=3: l=0 har 2 elektroner, l=1 har 6 elektroner, l=2 har 10 elektroner
En atomorbital tilhører et atom og kan beskrives matematisk som en løsning på schrödingerligningen. Hvert atom eller molekyl har tilgjengelig flere orbitaler med forskjellig utstrekning og form, hvor utstrekningen i realiteten er en visualisering av sannsynligheten for at elektronet befinner seg et gitt sted. Orbitalene med lavest energi fylles opp først av atomets elektroner.
Molekylorbitaler er de tilgjengelige energitilstandene som elektroner kan befinne seg i i et molekyl. Slike tilstander vil generelt sett være forskjellige fra tilstandene som er tilgjengelige i enkeltatomer.
Historie
I atommodellen til Niels Bohr beveger elektronene seg i sirkelbaner (på engelsk orbit) omkring atomkjernen. I atommodellen til Erwin Schrödinger, som erstattet Bohrs, befinner elektronene seg i en mer diffus sky som kalles en orbital. Det er et nytt ord laget fra orbit, og orbitalen beskriver matematisk den kvantemekaniske sannsynlighetsfordelingen til elektronet som er beskrevet ovenfor.
Navnene til orbitalene bruker en kombinasjon av bokstaver og tall til å karakterisere energien og spinnet til elektronene. Bokstavene har sin opprinnelse fra hvordan tidlige spektroskopiske målinger ble beskrevet, slik som s for «sharp», p for «principal».
Les mer i Store norske leksikon




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.