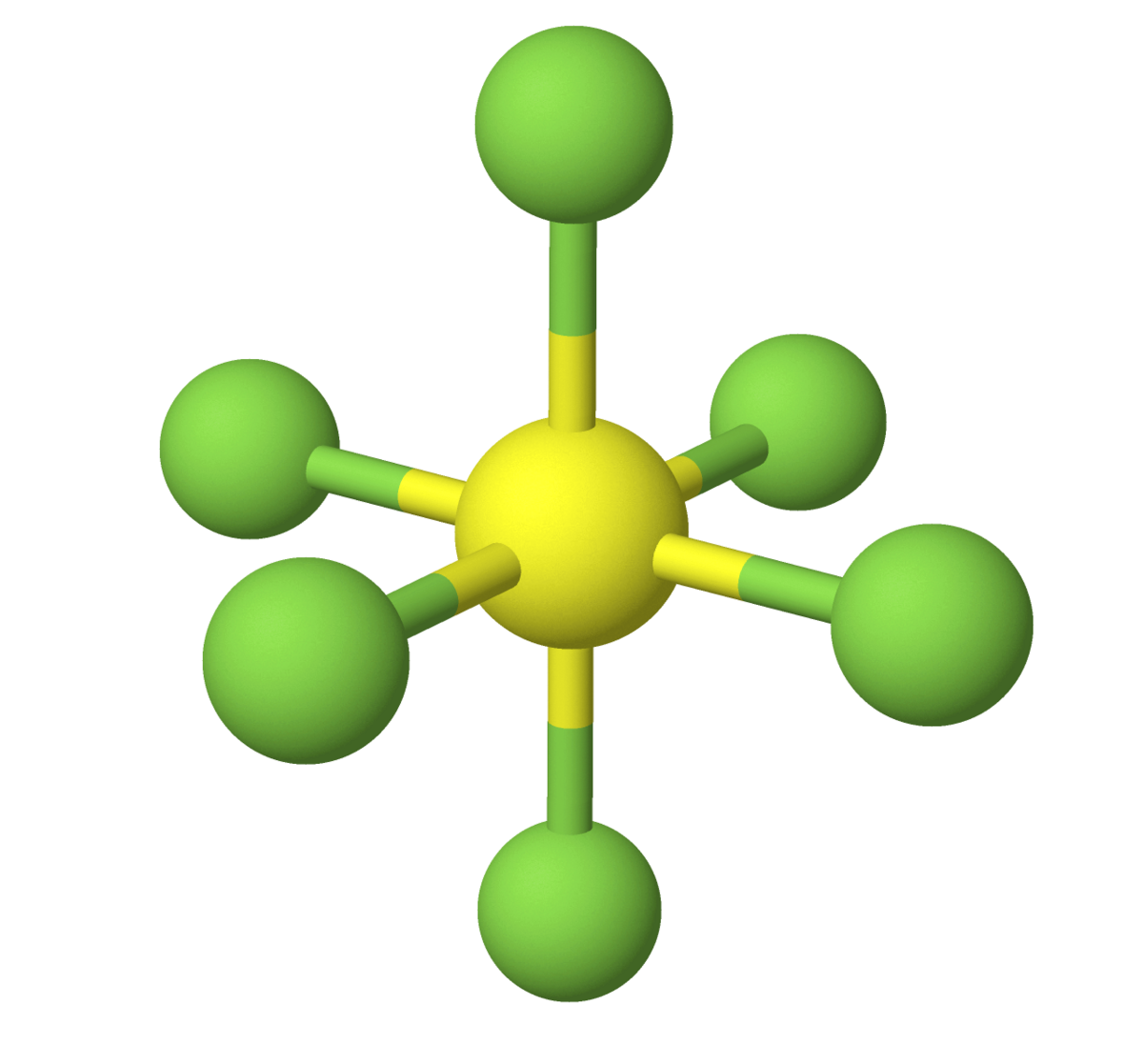
Svovelheksafluorid har kjemisk formel SF6. Forbindelsen er en farge- og luktløs, ikke brennbar gass med smeltepunkt −51 °C ved 2,29 atm. Svovelheksafluorid sublimerer ved −64 °C.
Gassen er ikke giftig, den er meget stabil og elektrisk isolerende. Den brukes derfor i elektriske høyspenningsanlegg. Den brukes også i flerlags vinduer. Gassen kan også brukes til å merke og påvise forurensninger i luften.
Svovelheksafluorid er en effektiv drivhusgass, da den absorberer infrarød stråling. Ett molekyl svovelheksafluorid er i så måte like effektivt som 7 200 karbondioksidmolekyler. Svovelheksafluorid er også stabil i atmosfæren med en levetid på minst 3000 år. Da bruken av svovelheksafluorid stadig øker, har mengden av gassen i atmosfæren blitt omtrent doblet fra 1998. Den er i dag ca. 80 ppt. Mengden karbondioksid er ca. 400 ppm. Det betyr at det er 2 millioner karbondioksidmolekyler per svovelheksamolekyl i atmosfæren. Bidraget fra svovelheksafluorid er dermed bare 4 promille av bidraget fra karbondioksid.
Grenseverdien for SF6 i arbeidsmiljø er satt til 6000 mg/m3 = 1000 ppm, som er grenseverdien for ikke-giftige gasser. Kjemisk sett er SF6 usedvanlig indifferent. Den kan for eksempel oppvarmes med hydrogen uten at det dannes hydrogenfluorid.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.