Metallbinding er en type kjemisk binding som oppstår mellom metallatomer i metaller, legeringer og intermetalliske forbindelser.
Faktaboks
- Uttale
- metˈallbinding
Metallbinding er en type kjemisk binding som oppstår mellom metallatomer i metaller, legeringer og intermetalliske forbindelser.
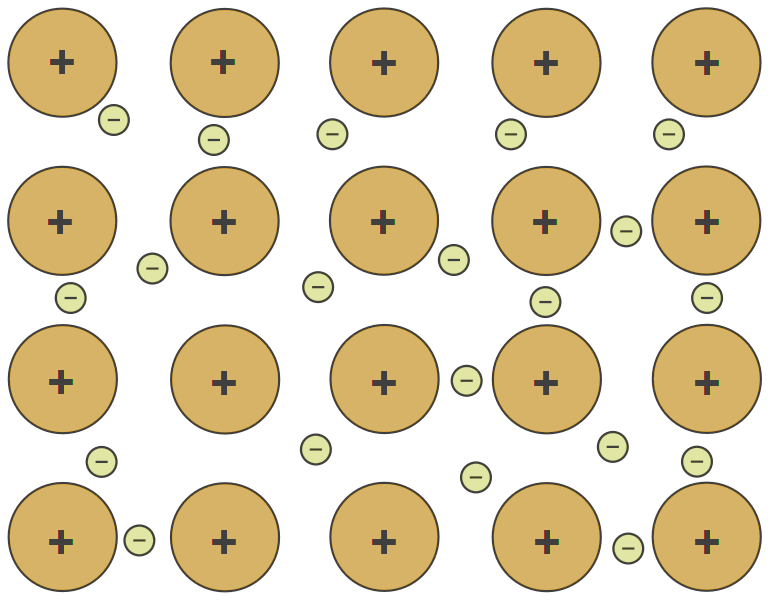
Metallbindinger oppstår mellom atomer med lav elektronegativitet. Bindingen kan beskrives som en elektronsky som ligger mellom positivt ladde metallioner. I denne beskrivelsen er den kjemiske bindingen ikke mellom atomene, men de positive metallatomene tiltrekkes av den negativt ladde skyen. En viktig konsekvens er at man kan forskyve metallatomene i forhold til hverandre uten å svekke bindingene, og det betyr at metallet kan deformeres uten å miste sin styrke.
Modellen med en elektronsky forklarer også hvorfor metaller er helt ugjennomsiktige, og hvorfor de stopper varmestråling, mikrobølger og radiobølger, hvorfor de har en metallisk glans og leder strøm og varme effektivt. Også metallenes tendens til å oksideres, det vil si at de kan avgi elektroner og avgi positive ioner, kan forklares utfra en slik modell.
For å finne årsaken til den store variasjonen i hardhet mellom metallene, må man anta at det er også noen kovalente bindinger mellom metallatomene. Den store hardheten og det ekstremt høye koke- og smeltepunktet for wolfram er for eksempel en direkte konsekvens av halvfullt d-skall, og medfølgende evne til å danne mange bindinger med naboatomene.
Andre metaller, for eksempel de svært myke alkalimetallene, det flytende kvikksølvet og det myke gullet, kan beskrives ved at alle valenselektronene inngår i elektronskyen og at det derfor ikke er elektroner igjen som kan danne kovalente bindinger.
Elektronskyen kan sees på som en utvidelse av kovalente bindinger, hvor valenselektronene overlapper med elektroner fra mange atomer. Elektroner som overlapper, vil få forskjellig energi, og når svært mange elektroner overlapper, vil de til slutt danne et nær kontinuerlig spektrum av energier. Mens kovalente forbindelser bare kan absorbere elektromagnetisk stråling tilsvarende sprang mellom spesifikke energinivåer, så gjør det store antallet energinivåer at ethvert foton vil tilsvare et energisprang i metaller. Dette medfører også at elektroner lett kan hoppe fra et energinivå til et annet; noe som medfører at det flytter fra ett atom til et annet.
Effekten oppstår bare hvis antall metallatomer er stort nok. Av den grunn vil metallene miste sine metalliske egenskaper hvis kornene blir meget små. Man utnytter denne effekten i fotografering, der sølvkornene er svarte, og i glassfarging, der finfordelt gull gir en markant rød farge.

Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.