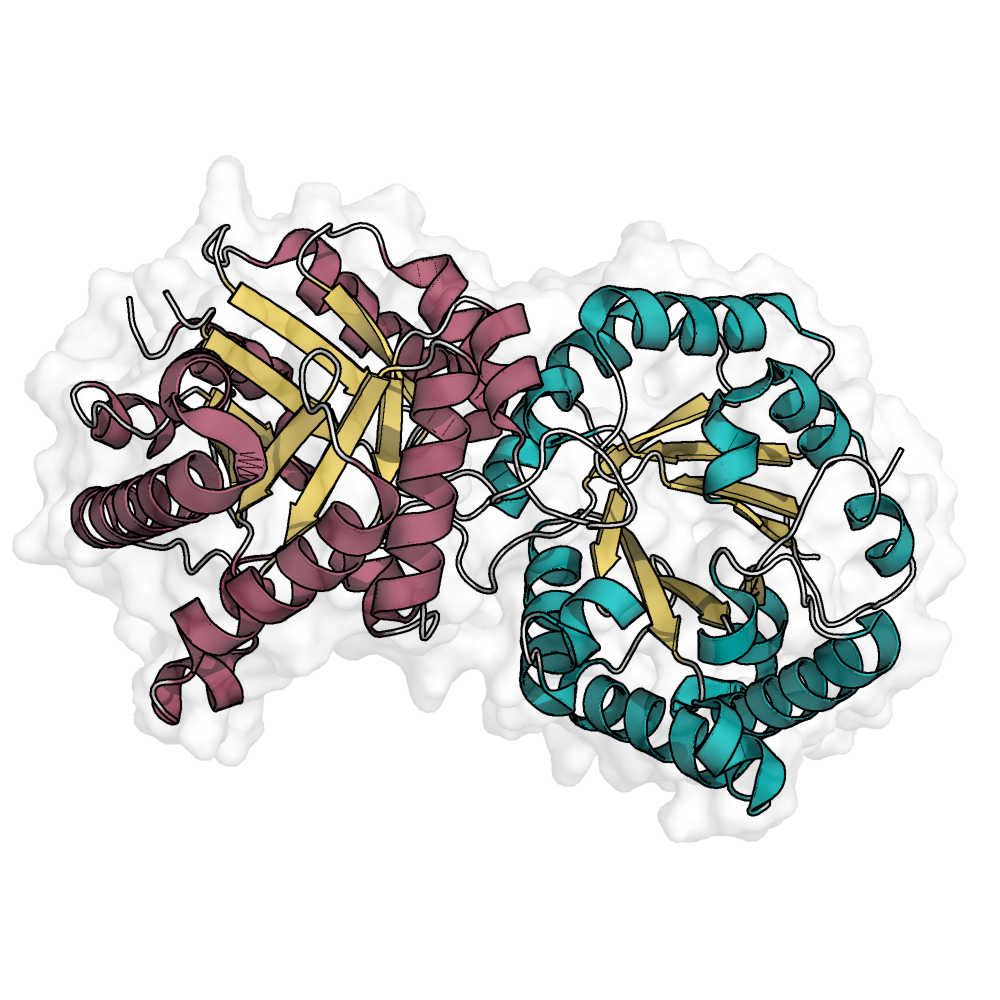
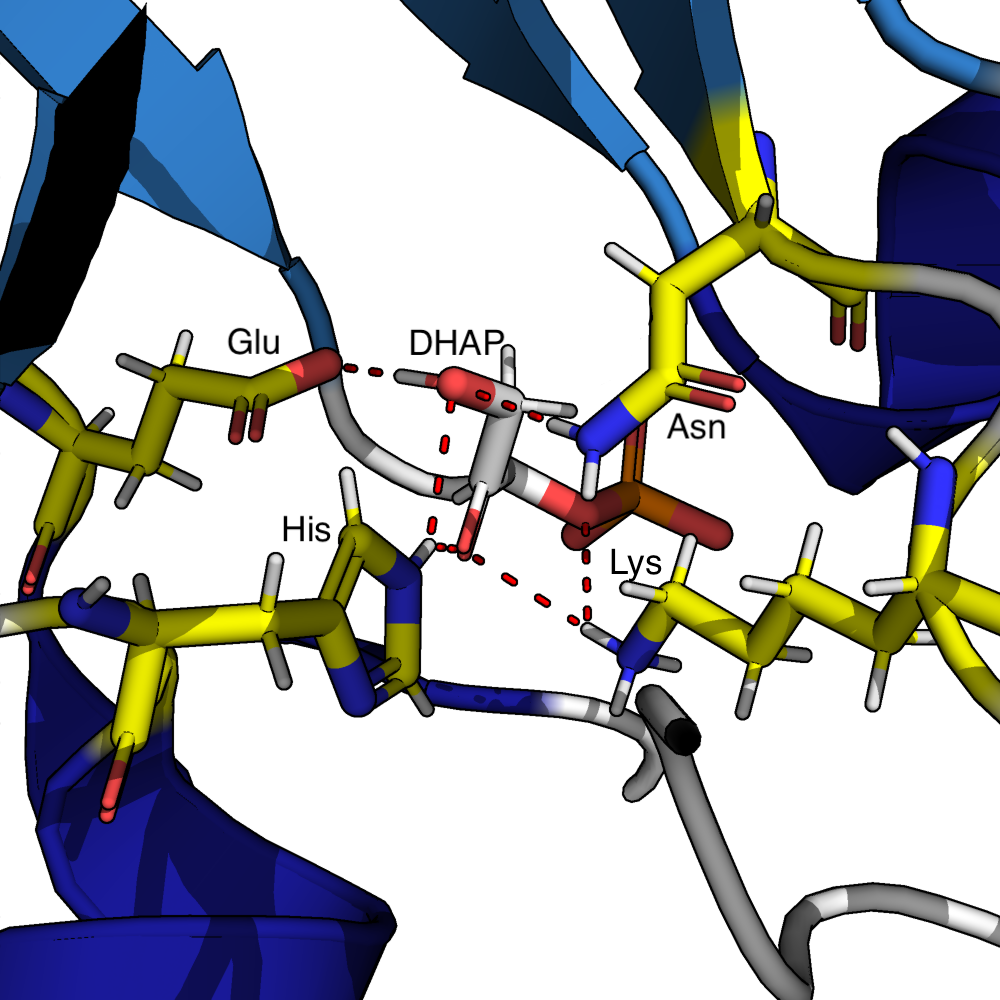
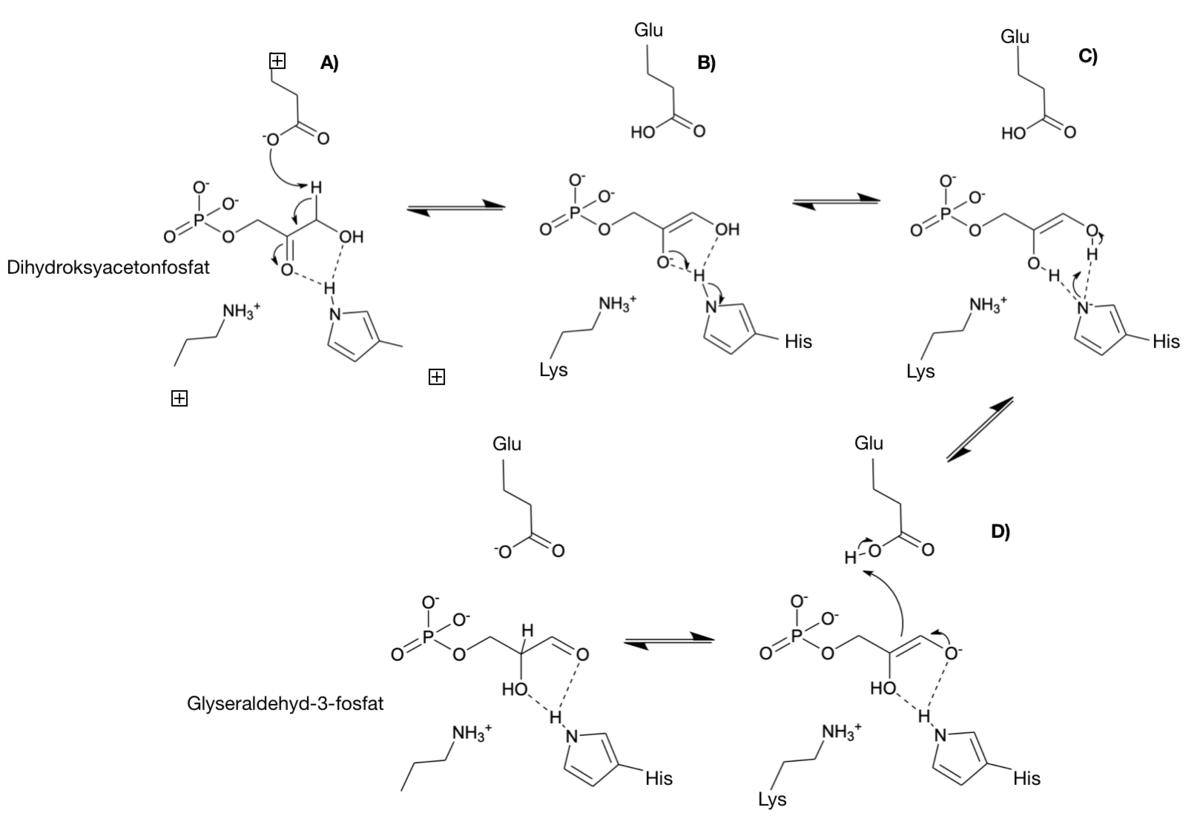
Triosefosfatisomerase er et enzym som deltar i nedbrytningen av sukkerlagringsmolekylet glykogen (glykolysen). Enzymet bidrar i det femte trinnet i glykolysen og katalyserer likevekten (se kjemisk likevekt) mellom sukkermolekylene ketose og aldose.
I tillegg til sin funksjon under glykolysen er triosefosfatisomerase innblandet i flere metabolske prosesser, deriblant pentosefosfatsyklus, glukoneogenese, fettsyntese, og Calvinsyklusen, som er en del av fotosyntesen.
Triosefosfatisomerasemangel er en sjelden medfødt sykdom som kan gi forstyrrelser i flere av kroppens systemer. Mangeltilstanden kan blant annet medføre symptomer der de røde blodcellene går i stykker (hemolytisk anemi) og forstyrrelser i nervesystemet.


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.