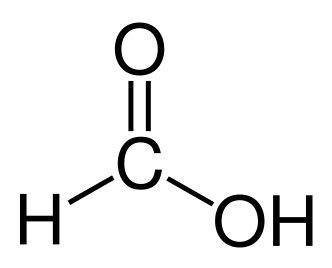
Maursyre er en kjemisk forbindelse med en stikkende og gjennomtrengende lukt. Den er en organisk syre. Maursyre er en fargeløs væske som koker ved 101 °C. Den kjemiske formelen er HC(O)OH.
maursyre
Kjemiske egenskaper
Maursyre er den enkleste av karboksylsyrene. Den er et reduksjonsmiddel (den reduserer for eksempel gullioner og sølvioner til de respektive metallene) og er ti ganger surere enn eddiksyre.
Ved oppvarming sammen med konsentrert svovelsyre spaltes den i karbonmonoksid og vann, som vist i denne reaksjonsligningen:
HC(O)OH → CO + H2O
Fremstilling
Maursyre kan dannes ved oksidasjon av metanol eller ved reduksjon av karbondioksid.
Industriell produksjon av maursyre skjer i dag hovedsakelig gjennom av en totrinns prosess. I det første trinnet karbonyleres metanol, hvorpå det dannes metylformiat. I det andre trinnet hydrolyseres metylformiat, og det dannes maursyre:
CH3OH + CO → HC(O)OCH3
HC(O)OCH3 + H2O → HC(O)OH + CH3OH
Anvendelse
På grunn av sin antiseptiske virkning brukes maursyre mye i landbruket, særlig ved produksjon av silofôr og rundballer, se ensilering. Maursyre ble tidligere benyttet som tilsetningsstoff i næringsmidler, men er i dag forbudt innen EU.
Maursyre brukes teknisk i store mengder blant annet til fremstilling av beis i fargeriene eller til avkalkning av lær i garverier.
Maursyre har god middrepende effekt og benyttes til dette formålet innen birøkt. Flere av maursyrens estere, for eksempel etyl- og amylformiat, brukes som tilsetning til essenser på grunn av sin fruktlignende lukt.
Les mer i Store norske leksikon
Faktaboks
- Systematisk navn
- maursyre




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.